
【题目】下面是一些晶体的结构示意图。
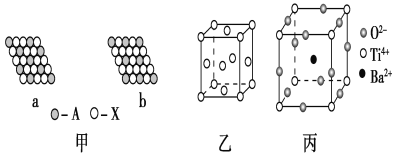
(1)下列关于晶体的说法正确的是________(填字母)。
A.晶体的形成与晶体的自范性有关
B.可以用X射线衍射仪区分晶体和非晶体
C.石蜡是非晶体,但有固定的熔点
D.晶胞就是晶体
(2)图甲表示的是晶体的二维平面示意图,a、b中可表示化学式为AX3的化合物的是________。(填“a”或“b”)
(3)图乙表示的是金属铜的晶胞,请完成以下各题:
①该晶胞“实际”拥有的铜原子数是________,铜原子的配位数为________。
②该晶胞称为________(填字母)。
A.六方晶胞
B.体心立方晶胞
C.面心立方晶胞
(4)图丙为钛酸钡晶体的晶胞结构,该晶体经X射线分析得出,重复单位为立方体,顶点位置被Ti4+所占据,体心位置被Ba2+所占据,棱心位置被O2-所占据。
①写出该晶体的化学式:_____________________________。
②若将Ti4+置于晶胞的体心,Ba2+置于晶胞顶点,则O2-处于立方体的________位置。
③Ti4+的氧配位数和Ba2+的氧配位数分别为________________。
【答案】AB b 4 12 C BaTiO3 面心 6、12
【解析】
(1)A.在一定条件下,物质能形成具有几何形状的晶体,这个过程与晶体的自范性有关,故正确;
B.晶体与非晶体最本质的区别是组成物质的粒子在微观空间是否有序排列,X射线衍射可以看到微观结构,所以区别晶体与非晶体最可靠的科学方法是对固体进行X-射线衍射实验,故正确;
C.非晶体没有固定的组成,也就没有固定的熔点,故错误;
D.晶体是由数量庞大的晶胞无隙并置而成的,故错误;
综上所述,本题选AB;
(2)a图中每个黑球周围有6个白色球,而每个白色球为3个黑球共有,故黑球与白色球数目之比=1:6×1/3=1:2,b图中每个黑球周围有6个白色球,而每个白色球为2个黑球共有,故黑球与白色球数目之比=1:6×1/2=1:3,求出化学式分别为a图为AX2、b图为AX3;综上所述,本题选b;
(3)①根据图片知,该晶胞中含有6个半个球、8个1/8球,则该晶胞中Cu原子个数=8×1/8+6×1/2=4;在铜的晶胞中,顶点上的铜原子被8个晶胞占有,每个晶胞中与一个顶点上铜原子距离最近的铜原子数是3,每个面上的铜原子被2个晶胞占有,所以其配位数是3×8×1/2=12;综上所述,本题答案是:4,12。
②晶胞中铜原子位于顶点和面心,即晶胞类型为面心立方晶胞,所以C选项是正确;综上所述,本题选C。
(4)①由结构可知,Ba2+位于体心有1个,Ti4+位于顶点,数目为8×1/8=1个,O2-位于棱心,数目为12×1/4=3个,故其化学式为BaTiO3;综上所述,本题答案是:BaTiO3。
②根据晶胞结构可知,每个Ti4+周围有6个O2-,若Ti4+位于晶胞的体心,Ba2+位于晶胞的顶点,则O2-处于立方体面心上;综上所述,本题答案是:面心。
③根据晶胞的结构可知,每个Ti4+周围有6个O2-,所以Ti4+的氧配位数为6;立方晶胞12条棱上的12个O原子均与体心Ba2+等距,所以Ba2+的氧配位数为12。综上所述,本题答案是:6,12。


 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:
【题目】“乙醇催化氧化”的实验装置如图所示:
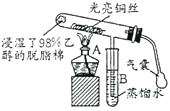
实验操作为:预先使棉花团浸透乙醇,并照图安装好仪器,在铜丝的中间部位加热片刻后,用气囊有节奏地鼓入空气,即可观察到以下明显的实验现象。
请回答以下问题:
(1)在实验过程中铜丝出现红色和黑色交替的现象,说明在该实验过程中催化剂_________![]() 填“参与了”或“没有参与”
填“参与了”或“没有参与”![]() 化学反应;写出乙醇催化氧化反应的化学方程式_________。
化学反应;写出乙醇催化氧化反应的化学方程式_________。
(2)在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明乙醇催化氧化反应是____反应。
(3)B中用蒸馏水收集到的物质可能有__________![]() 填物质的名称
填物质的名称![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以电石渣[主要成分为Ca(OH)2和CaCO3]为原料制备KClO3的流程如下:
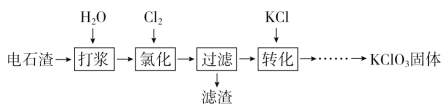
(1)氯化过程控制电石渣过量、在75 ℃左右进行。氯化时存在Cl2与Ca(OH)2作用生成Ca(ClO)2的反应,Ca(ClO)2进一步转化为Ca(ClO3)2。
①电石与H2O反应的化学方程式为___________________。生成Ca(ClO)2的化学方程式为___________________。
②提高Cl2转化为Ca(ClO3)2的转化率的可行措施有________(填序号)。
A.适当加快通入Cl2速率
B.充分搅拌浆料
C.加水使Ca(OH)2完全溶解
(2)氯化过程中Cl2转化为Ca(ClO3)2的总反应方程式为:6Ca(OH)2+6Cl2===Ca(ClO3)2+5CaCl2+6H2O,氯化完成后过滤。
75 ℃时 Ca(ClO)2进一步转化为Ca(ClO3)2的反应方程式为__________________。
滤渣的主要成分为________(填化学式)。
(3)向滤液中加入稍过量KCl固体可将Ca(ClO3)2转化为KClO3的原因是________。
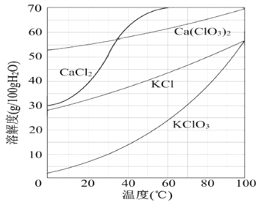
若溶液中KClO3的含量为100 g·L-1,从该溶液中尽可能多地析出KClO3固体的方法是_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某酸性溶液中含有Ba2+、Fe3+,则下述离子组中能与上述离子共存的是
A.NO3-、Cl-B.CO32-、Cl-C.NO3-、SO42-D.OH-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烧碱样品含少量不与酸作用的杂质,为了测定其纯度,进行以下滴定操作:
A.在250 mL的容量瓶中定容配成250 mL烧碱溶液
B.用移液管移取25 mL烧碱溶液于锥形瓶中并滴几滴甲基橙指示剂
C.在天平上准确称取烧碱样品W g,在烧杯中用蒸馏水溶解
D.将物质的量浓度为c的标准硫酸溶液装入酸式滴定管,调节液面,记下开始读数为V1
E.在锥形瓶下垫一张白纸,滴定至终点,记下读数V2
回答下列各问题:
(1)正确操作步骤的顺序是________ →________ →________ →D→________(均用字母填写)。
(2)滴定管的读数应注意_________________________________。
(3)E中在锥形瓶下垫一张白纸的作用是____________________。
(4)D步骤中液面应调节到____________________,尖嘴部分应__________________。
(5)滴定终点时锥形瓶内溶液的pH约为________,终点时颜色变化是_____________________________________________________。
(6)若酸式滴定管不用标准硫酸润洗,在其他操作均正确的前提下,会对测定结果(指烧碱的纯度)有何影响?________(填“偏高”“偏低”或“不变”)。
(7)该烧碱样品纯度的计算式为___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应由两步反应A![]() B
B![]() C构成,反应过程中的能量变化曲线如图(E1、E3表示两反应的活化能)。下列有关叙述正确的是
C构成,反应过程中的能量变化曲线如图(E1、E3表示两反应的活化能)。下列有关叙述正确的是

A. 三种化合物的稳定性顺序:B﹤A﹤C
B. 两步反应均为放热反应
C. 加入催化剂不改变反应的焓变,但能提高产率
D. 整个反应的ΔH=E1-E2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳是形成化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质。
请回答下列问题:
(1)有机物M经过太阳光光照可转化成N,转化过程如下:
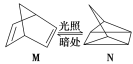 ΔH=+88.6 kJ·mol-1
ΔH=+88.6 kJ·mol-1
则M、N相比,较稳定的是 。
(2)已知CH3OH(l)的燃烧热为238.6 kJ·mol-1,CH3OH(l)+![]() O2(g)=CO2(g)+2H2(g) ΔH=-a kJ·mol-1,则a 238.6(填“>”、“<”或“=”)。
O2(g)=CO2(g)+2H2(g) ΔH=-a kJ·mol-1,则a 238.6(填“>”、“<”或“=”)。
(3)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1 mol Cl2参与反应时释放出145 kJ热量,写出该反应的热化学方程式: 。
(4)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,4Al(s)+3TiO2(s)+3C(s)=2Al2O3(s)+3TiC(s) ΔH=-1 176 kJ·mol-1,则反应过程中,每转移1 mol电子放出的热量为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com