
【题目】下列有关烷烃的叙述中,不正确的是
A. 在烷烃分子中,所有的化学键都为单键
B. 所有的烷烃在光照条件下都能与Cl2发生取代反应
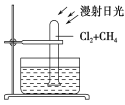
C. 如图所示,将1体积甲烷和4体积Cl2充入试管中,一段时间后,将看到水槽底部有油状液滴生成,试管内充满水
D. 甲烷与Cl2在光照条件下发生反应的产物中,HCl的浓度最大
【答案】C
【解析】
A.烷烃属于饱和链烃,不存在不饱和键,则在烷烃分子中所有的化学键都为单键,故A正确;
B.烷烃的特征反应为取代反应,所有的烷烃在一定条件下都能与Cl2发生取代反应,故B正确;
C.CH4和Cl2光照发生取代反应,生成CH3Cl(气体)、CH2Cl2、CHCl3、CCl4、HCl,随着反应进行,Cl2不断消耗,黄绿色逐渐消失,生成的CH2Cl2、CHCl3、CCl4常温下均为无色油状液体,将看到水槽底部有油状液滴生成;因生成的HCl易溶于水,反应后,试管内气体压强减小,水位在试管内上升,但CH3Cl为不溶于水的气体,则试管内不可能完全充满水,故C错误;
D.甲烷和氯气在光照条件下发生取代反应,生成CH3Cl(气体)、CH2Cl2、CHCl3、CCl4、HCl,其中CH3Cl(气体)、CH2Cl2、CHCl3、CCl4的量不确定,总物质的量等于参加反应的CH4的物质的量,而生成HCl的物质的量与参加反应的Cl2的物质的量相等,且明显大于任何一种有机生成物,即产物中HCl的浓度最大,故D正确;答案为C。


科目:高中化学 来源: 题型:
【题目】氮元素是空气中含量最多的元素,在自然界中的分布十分广泛,在生物体内亦有极大作用。一定条件下,含氮元素的物质可发生如图所示的循环转化。回答下列问题:
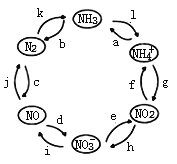
(1)氮分子的电子式为______________________。
(2)图中属于“氮的固定”的是___________(填字母)。
(3)已知NH4Cl溶液呈酸性,用离子方程式解释原因___________________________________________ 。
(4)用离子方程式举一例表示循环中发生非氧化还原反应的过程__________________。
(5)若反应h是在NO2与H2O的作用下实现,则该反应中氧化剂与还原剂物质的量之比为____________。
(6)若反应i是在酸性条件下由NO3—与Fe2+的作用实现,则该反应的离子方程式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,ΔH1=-393.5kJ·mol-1,ΔH2=-395.4kJ·mol-1,

下列说法或表示式正确的是
A. 石墨和金刚石的转化是物理变化
B. C(s、石墨)===C(s、金刚石)ΔH =+1.9kJ·mol-1
C. 金刚石的稳定性强于石墨
D. 断裂1mol石墨的化学键吸收的能量比断裂1mol金刚石的化学键吸收的能量少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验小组用下列装置进行乙醇催化氧化的实验。已知:乙醛可被氧化为乙酸。
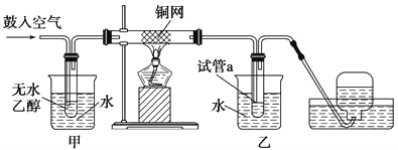
(1)实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学方程式__________________ 、_____________________。
(2)在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明该乙醇催化反应是____________ 反应。进一步研究表明,鼓入空气的速率与反应体系的温度关系曲线如图所示。
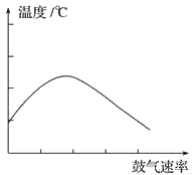
试解释出现图中现象的原因_______________________。
(3)甲和乙两个水浴作用不相同。甲的作用是_______________;乙的作用是______________。
(4)若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有_______。要除去该物质,可在混合液中加入________ (填写字母)。然后,再通过________________(填实验操作名称)即可除去。
A.氯化钠溶液 B.苯 C.碳酸氢钠溶液 D.四氯化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用KMnO4和浓盐酸反应制取氯气。其变化可表述为:
2KMnO4+16HCl(浓) ===2KCl+2MnCl2+5Cl2↑+8H2O
(1)请将上述化学方程式改写为离子方程式________________。
(2)浓盐酸在反应中显示出来的性质是________________(填写编号,多选倒扣)。
①只有还原性 ②还原性和酸性
③只有氧化性 ④氧化性和酸性
(3)此反应中氧化产物是_________(填化学式),产生0.5 mol Cl2,则转移的电子的物质的量为______mol。
(4) 用双线桥法表示该反应的电子转移的方向和数目
_____
2KMnO4+16HCl(浓) ===2KCl+2MnCl2+5Cl2↑+8H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示的实验设计能实现相应实验目的的是
A. 
验证FeCl3溶液中是否含有Fe2+
B. 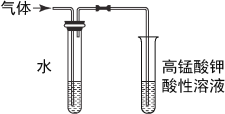
检验溴乙烷消去的产物
C. 
检验氯气与亚硫酸钠是否发生反应
D. 
对比Fe3+和Cu2+对H2O2分解的催化效果
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F为前四周期元素且原子序数依次增大,其中基态A原子的电子分布在3个能级,且每个能级所含的电子数相同;C的原子核外最外层有 6 个运动状态不同的电子;D是短周期元素中电负性最小的元素;E的最高价氧化物的水化物酸性最强;基态F原子核外最外层只有一个电子,其余能层均充满电子。G元素与D元素同主族,且相差3个周期。
(1)元素 A、 B、 C 的第一电离能由小到大的是__________________(用元素符号表示)。
(2)E的最高价含氧酸中 E 原子的杂化方式为_____________。 基态 E 原子中,核外电子占据最高能级的电子云轮廓形状为_________________。
(3)F原子的外围电子排布式为_______________________,
(4)已知元素 A、B形成的(AB)2分子中所有原子都满足 8电子稳定结构,则其分子中 σ键与 π键数目之比为__________。
(5)通常情况下,D单质的熔沸点比G单质高,原因是_________________________。
(6)已知 DE 晶体的晶胞如图所示:
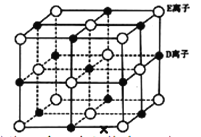
若将 DE 晶胞中的所有 E 离子去掉,并将 D 离子全部换为 A 原子,再在其中的 4 个“小立方体”中心各放置一个A 原子,且这 4 个“小立方体”不相邻。位于“小立方体”中的 A 原子与最近的 4 个 A 原子以单键相连,由此表示 A的一种晶体的晶胞(已知 A—A 键的键长为a cm, NA表示阿伏加德罗常数),则该晶胞中含有_________个 A 原子,该晶体的密度是_______g·cm-3(列式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 根据反应Cu+H2SO4![]() CuSO4+H2↑可推出Cu的还原性比H2的强
CuSO4+H2↑可推出Cu的还原性比H2的强
B. 电解含Pb(NO3)2和Cu(NO3)2的溶液,阴极上阳离子得电子次序依次是Cu2+、H+、Pb2+
C. 含amolNa2S的溶液最多能吸收2.5amol的二氧化硫气体(不考虑SO2在水中的溶解)
D. 由置换反应I2+2NaClO3===2NaIO3+Cl2可知I2的氧化性强于Cl2的氧化性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com