
【题目】实验室可用KMnO4和浓盐酸反应制取氯气。其变化可表述为:
2KMnO4+16HCl(浓) ===2KCl+2MnCl2+5Cl2↑+8H2O
(1)请将上述化学方程式改写为离子方程式________________。
(2)浓盐酸在反应中显示出来的性质是________________(填写编号,多选倒扣)。
①只有还原性 ②还原性和酸性
③只有氧化性 ④氧化性和酸性
(3)此反应中氧化产物是_________(填化学式),产生0.5 mol Cl2,则转移的电子的物质的量为______mol。
(4) 用双线桥法表示该反应的电子转移的方向和数目
_____
2KMnO4+16HCl(浓) ===2KCl+2MnCl2+5Cl2↑+8H2O
【答案】 2MnO4—+16H++10Cl—===2Mn2++5Cl2↑+8H2O ② Cl2 1 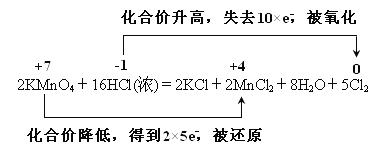
【解析】(1)反应中的盐和酸均易溶,拆成离子,单质和水不能拆,2KMnO4+16HCl(浓) =2KCl+2MnCl2+5Cl2↑+8H2O的离子方程式为:2MnO4—+16H++10Cl—===2Mn2++5Cl2↑+8H2O;(2)浓盐酸在反应中显示出来的性质是还原性和酸性,答案选②;(3)此反应中盐酸被氧化生成氯气,氧化产物是Cl2;反应中氯元素从-1价变为0价,产生0.5 mol Cl2,则转移的电子的物质的量为1mol;(4) 用双线桥法表示该反应的电子转移的方向和数目如下: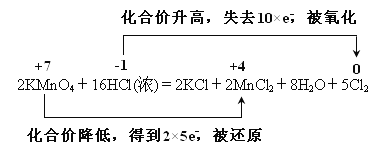 。
。


科目:高中化学 来源: 题型:
【题目】用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气的生成速率加快的是
A. 加热 B. 不用稀硫酸改用98%的浓硫酸
C. 滴加少量的CuSO4溶液 D. 不用铁片改用铁粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、配平下列方程式:
____MnO![]() +____H++____Cl- === ____Mn2++____Cl2↑+____H2O
+____H++____Cl- === ____Mn2++____Cl2↑+____H2O
____H2S+____HNO3 ===____S↓+____NO↑+____H2O
II、KClO3 和浓盐酸在一定温度下反应会生成黄绿色的易爆物二氧化氯,其化学方程式为:
2KClO3 +4HCl(浓)=== 2KCl+2ClO2↑+Cl2↑+2H2O
(1)浓盐酸在反应中表现出来的性质是____(填写编号)
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(2)产生 0.1molCl2,则转移电子的物质的量为____mol。
(3)用单线桥法标出该反应的电子转移的方向和数目。____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列陈述正确并且有因果关系的是
选项 | 陈述Ⅰ | 陈述Ⅱ |
A | SO2有漂白性 | SO2可使溴水褪色 |
B | SiO2有导电性 | SiO2可用于制备光导纤维 |
C | 浓硫酸有强氧化性 | 浓硫酸可用于干燥H2和CO |
D | Fe3+有强氧化性 | FeCl3溶液可用于回收废旧电路板中的铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某主族元素R的最高正化合价与最低负化合价的代数和为6,由此可以判断
A.R可能是第二周期元素
B.R一定是ⅥA族元素
C.R的气态氢化物比同周期其它元素气态氢化物稳定
D.R气态氢化物化学式为H2R
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷的一些化合物常用作半导体、除草剂、杀鼠药等。回答下列问题:
(1)基态As原子的核外电子排布式为[Ar]__________,有___________个未成对电子。
(2)镓氮砷合金材料的太阳能电池效率达40%。Ga、N、As电负性由大至小的顺序是_____________。
(3)As4O6的分子结构如图所示,其中As原子的杂化方式为____________,1mol 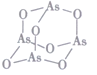 As4O6含有σ键的物质的量为________mol。
As4O6含有σ键的物质的量为________mol。
(4)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置,LiZnAs基稀磁半导体的晶胞如图所示,其中原子
坐标参数A处Li为(0,0, ![]() );B处As为(
);B处As为(![]() ,
, ![]() ,
, ![]() );C处Li的坐标参数为_____________。
);C处Li的坐标参数为_____________。
②晶胞参数,描述晶胞的大小和形状,已知LiZnAs单晶的晶胞参数α=594 pm,NA表示阿伏加德罗常数的数值,其密度为____________g·cm-3(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是()
A. 原子半径:Cl>S>P B. 还原性:Na>Mg>Al
C. 稳定性:HF>HCl>HBr D. 酸性:HClO4>H2SO4>H3PO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com