
下列有关原子结构和元素周期律的表述正确的是…( )
①原子序数为15的元素的最高化合价为+3 ②ⅦA族元素是同周期中非金属性最强的元素 ③第二周期ⅣA族元素的原子核电荷数和中子数一定为6 ④原子序数为12的元素位于元素周期表的第三周期ⅡA族
A.①② B.①③ C.②④ D.③④
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
某学生用如下图所示装置进行化学反应X+2Y=2Z能量变化情况的研究。当往试管中滴加试剂Y时,看到导管中甲处液面下降,乙处液面上升。关于该反应的下列叙述正确的是
① 该反应为放热反应;② 生成物的总能量比反应物的总能量高;③ 该反应过程可以看成是“贮存”于X、Y内部的能量转化为热量而释放出来。
A.①③ B.①②③ C.①② D.②
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙、丙、丁、戊为原子序数依次增大的短周期元素。甲、丙处于同一主族,丙、丁、戊处于同一周期,戊原 子的最外层电子数是甲、乙、丙原子最外层电子数之和。甲、乙组成的成的常见气体X能使湿润的红色石蕊试纸变蓝;戊的单质与X反应能生成乙的单质,同时生成两种溶于水均呈酸性的化合物Y和Z,0.1mol/L的Y溶液pH>1;丁的单质既能与丙元素最高价氧化物的水化物的溶液反应生成盐L也能与Z的水溶液反应生成盐;丙、戊可组成化合物M。
子的最外层电子数是甲、乙、丙原子最外层电子数之和。甲、乙组成的成的常见气体X能使湿润的红色石蕊试纸变蓝;戊的单质与X反应能生成乙的单质,同时生成两种溶于水均呈酸性的化合物Y和Z,0.1mol/L的Y溶液pH>1;丁的单质既能与丙元素最高价氧化物的水化物的溶液反应生成盐L也能与Z的水溶液反应生成盐;丙、戊可组成化合物M。
请回答下列问题
(1) 戊离子的结构示意图为_______。
(2) 与出乙的单质的电子式:_______。
(3) 戊的单质与X反应生成的Y和Z的物质的量之比为2:4,反应中被氧化的物质与被还原的物质的物质的量之比为________。
(4) 写出少量Z的稀溶液滴入过量L的稀溶液中发生反应的离子方程式:_________。
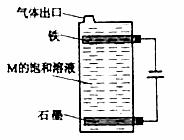
(5) 按下图电解M的饱和溶液,写出该电解池中发生反应的总反应方程式:_______。将充分电解后所得溶液逐滴加入到酚酞试液中,观察到得现象是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知周期表中,元素Q、R、W、Y与元素X相邻。Y的最高化合价氧化物的水化物是强酸。回答下列问题:
(1)W与Q可以形成一种高温结构陶瓷材料。W的氯化物分子呈正四面体结构,W的氧化物的晶体类型是_____________________________________________;
(2)Q的具有相同化合价且可以相互转变的氧化物是__________________________;
(3)R和Y形成的二元化合物中,R呈现最高化合价的化合物的化学式是:_______________;
(4)这5个元素的氢化物分子中,①立体结构类型相同的氢化物的沸点从高到低排列次序是(填化学式)__________________,其原因是___________________________________;
②电子总数相同的氢化物的化学式和立体结构分别是________________________;
(5)W和Q所形成的结构陶瓷材料的一种合成方法如下:W的氯化物与Q的氢化物加热反应,生成化合物W(QH2)4和HCl气体;W(QH2)4在高温下分解生成Q的氢化物和该陶瓷材料。上述相关反应的化学方程式(各物质用化学式表示)是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
W、X、Y、Z是周期表前36号元素中的四种常见元素,其原子序数依次增大。W、Y的氧化物是导致酸雨的主要物质,X的基态原子核外有7个原子轨道填充了电子,Z能形成红色(或砖红色)的Z2O和黑色的ZO两种氧化物。
(1)W位于元素周期表第_________周期第_________族。W的气态氢化物稳定性比H2O(g)_________(填“强”或“弱”)。
(2)Y的基态原子核外电子排布式是_______,Y的第一电离能比X的_______(填“大”或“小”)。
(3)Y的最高价氧化物对应水化物的浓溶液与Z的单质反应的化学方程式是_____________。
(4)已知下列数据:
Fe(s)+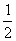 O2(g)====FeO(s) ΔH=-272.0 kJ·mol-1
O2(g)====FeO(s) ΔH=-272.0 kJ·mol-1
2X(s)+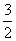 O2(g)====X2O3(s) ΔH=-1 675.7 kJ·mol-1
O2(g)====X2O3(s) ΔH=-1 675.7 kJ·mol-1
X的单质和FeO反应的热化学方程式是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在2008年初我国南方遭遇的冰雪灾害中,使用了一种融雪剂,其主要成分的化学式为XY2,X、Y均为周期表前20号元素,其阳离子和阴离子的电子层结构相同,且1 mol XY2含有54 mol电子。
(1)该融雪剂的化学式是__________;X与氢元素形成的化合物的电子式是_____________。
(2)元素D、E原子的最外层电子数是其电子层数的2倍,D与Y相邻,则D的离子结构示意图是________________;D与E能形成一种非极性分子,该分子的结构式为________________;D所在族元素的氢化物中,沸点最低的是_________________________。
(3)元素W与Y同周期,其单质是原子晶体;元素Z的单质分子Z2中有3个共价键;W与Z能形成一种新型无机非金属材料,其化学式是____________________________________。
(4)元素R与Y同主族,其氢化物能用于刻蚀玻璃,R2与NaOH溶液反应的产物之一是OR2,该反应的离子方程式为______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
D、E、X、Y、Z是周期表中的前20号元素,且原子序数逐渐增大,它们的最简氢化物分子的空间构型依次是正四面体、三角锥形、正四面体、角形(V形)、直线形。回答下列问题:
(1)Y的最高价氧化物的化学式为 ;
(2)上述5种元素中,能形成酸性最强的含氧酸的元素是 ,写出该元素的任意3种含氧酸的化学式: ;
(3)D和Y形成的化合物,其分子的空间构型为 ;
(4)D和X形成的化合物,其化学键类型属 ,其晶体类型属 ;
(5)金属镁和E的单质在高温下反应得到的产物是 ,此产物与水反应生成两种碱,该反应的化学方程式是 。
(6)试比较D和X的最高价氧化物熔点的高低并说明理由:
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素W、X、Y、Z 的原子序数依次增大,W与Y、X与Z 位于同一主族。W 与X 可形成共价化合物WX2,Y原子的内层电子总数是其最外层电子数的2.5 倍。下列叙述中不正确的是
A.WZ2分子中所有原子最外层都为8 电子结构
B.WX2、ZX2的化学键类型和晶体类型都相同
C.WX2是以极性键结合成的非极性分子
D.原子半径大小顺序为X <W<Y<Z
查看答案和解析>>
科目:高中化学 来源: 题型:
几种短周期元素的原子半径及主要化合价如下表:
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 70 | 66 |
| 主要化合价 | +2 | +3 | +5、+3、-3 | -2 |
下列叙述正确的是
A.X、Y元素的金属性X<Y
B.一定条件下,Z单质与W的常见单质直接生成ZW2
C.Y的最高价氧化物对应的水化物能溶于稀氨水
D.一定条件下,W单质可以将Z单质从其氢化物中置换出来
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com