
【题目】如图是以葡萄糖为燃料的微生物燃料电池结构示意图。关于该电池的叙述不正确的是( )
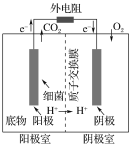
A.该电池不能在高温下工作
B.电池的负极反应为C6H12O6+6H2O-24e-=6CO2↑+24H+
C.放电过程中,电子从正极区向负极区每转移1 mol,便有1 mol H+从阳极室进入阴极室
D.微生物燃料电池具有高能量转换效率、原料较广泛、操作条件温和、有生物相容性等优点,值得研究与推广
【答案】C
【解析】
A. 微生物在高温条件下会失去生理活性;
B. 根据电解结构示意图中电子的移动方向可知左侧为负极,发生氧化反应;
C. 放电过程中电子只能在外电路中移动;
D. 微生物燃料电池具有高能量转换效率、原料较广泛、操作条件温和、有生物相容性等优点,值得研究与推广。
A. 微生物在高温条件下会失去生理活性,因此该电池不能在高温下工作,A项正确,不符合题意;
B. 根据电解结构示意图中电子的移动方向可知左侧为负极,发生氧化反应,生成CO2,电极反应为:C6H12O6+6H2O-24e-=6CO2↑+24H+,B项正确,不符合题意;
C. 放电过程中电子只能在外电路中移动,C项错误,符合题意;
D. 微生物燃料电池具有高能量转换效率、原料较广泛、操作条件温和、有生物相容性等优点,值得研究与推广,D项正确,不符合题意;
答案选C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某研究性学习小组研究含一定浓度Fe2+的溶液在不同条件下被氧气氧化的氧化率,实验结果如图所示,判断下列说法不正确的是
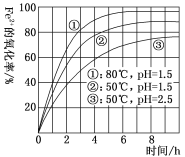
A.温度越高氧化率越大
B.pH越小氧化率越大
C.Fe2+的氧化率仅与溶液的pH和温度有关
D.实验说明降低pH、升高温度有利于提高Fe2+的氧化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E、F6种短周期元素,G为过渡元素;已知相邻的A、B、C、D 4种元素原子核外共有56个电子,在周期表中的位置如图所示。1molE单质与足量酸作用,在标准状况下能产生33.6LH2;E单质粉末与G的氧化物常用于野外焊接钢轨;F是短周期最活泼的金属元素。请回答下列问题:
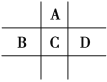
(1)元素D、G的名称分别为:__。
(2)D的单质与C的气态氢化物反应方程式为___。
(3)C、E、A的简单离子半径:__>__>__,B、C、D的最高价氧化物对应的水化物的酸性强弱顺序为___(用化学式表示)。
(4)向D与E形成的化合物的水溶液中滴加过量烧碱溶液的离子方程式为__。
(5)用电子式表示F与C形成化合物的过程___。
(6)G的单质与高温水蒸气反应的方程式___。
(7)部分元素在周期表中的分布如图所示(虚线为金属元素与非金属元素的分界线),下列说法不正确的是___。
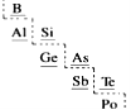
A.B只能得电子,不能失电子 B.原子半径Ge>Si
C.As可作半导体材料 D.Po处于第六周期第VIA族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在200ml含Mg2+、Al3+、NH4+、H+、Cl-的溶液中,逐滴加入5mol/L的NaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示。下列叙述不正确的是

A. x-y=0.01mol B. 原溶液中c(Cl-)=0.75mol·L-1
C. 原溶液的pH=1 D. 原溶液中n(Mg2+):n(Al3+)=5:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁被誉为“第一金属”,铁及其化合物在生活中有广泛应用。
(1)基态Fe3+的电子排布式为_________________。
(2)实验室用KSCN溶液、苯酚(![]() )检验Fe3+。N、O、S的第一电离能由大到小的顺序为______(用元素符号表示),苯酚中碳原子的杂化轨道类型为_______。
)检验Fe3+。N、O、S的第一电离能由大到小的顺序为______(用元素符号表示),苯酚中碳原子的杂化轨道类型为_______。
(3)FeCl3的熔点为306℃,沸点为315℃。FeCl3的晶体类型是________。FeSO4常作补铁剂,SO42-的立体构型是__________。
(4)羰基铁[Fe(CO)5]可用作催化剂、汽油抗暴剂等。1 mol Fe(CO)5分子中含________molσ键,与CO互为等电子体的离子是__________(填化学式,写一种)。
(5)氮化铁晶体的晶体结构示意图如图1所示。该晶体中铁、氮的微粒个数之比为_____。

(6)氧化亚铁晶体的晶胞如图2所示。已知:氧化亚铁晶体的密度为ρg·cm-3,NA代表阿伏加德罗常数的值。在该晶胞中,与Fe2+紧邻且等距离的Fe2+数目为_____;Fe2+与O2-的最短核间距为___________pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖授予约翰·古迪纳夫、斯坦利·威廷汉和吉野彰,表彰他们对锂离子电池研究的贡献。磷酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一。采用湿法冶金工艺回收废旧磷酸亚铁锂电池正极片(除LiFePO4外,还含有Al箔、少量不溶于酸碱的导电剂)中的资源,部分流程如图:
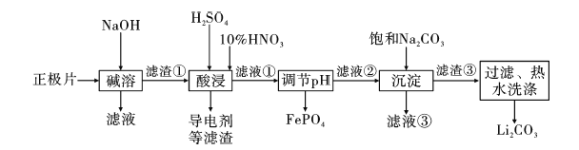
已知:Ksp ( Li2CO3)=1.6×10-3 。部分物质的溶解度(S)如下表所示:
T℃ | S(Li2CO3)/g | S(Li2SO4)/g | S(Li3PO4)/g |
20 | 1.33 | 34.2 | 0.039 |
80 | 0.85 | 30.5 | —— |
100 | 0.72 | —— |
(1)从“正极”可以回收的金属有___。
(2)写出碱溶时Al箔溶解的离子方程式___。
(3)磷酸亚铁锂电池在工作时,正极发生LiFePO4和FePO4的转化,该电池充电时正极的电极反应式为___。
(4)酸浸时产生标准状况下3.36LNO时,溶解 LiFePO4___mol(其他杂质不与HNO3反应),若用H2O2代替HNO3,发生反应的离子方程式为___。
(5)流程中用“热水洗涤”的原因是___。
(6)若滤液②中c(Li+)=4mol/L,加入等体积的Na2CO3后,Li+的沉降率到90%,计算滤液③中c(CO32-)=___mol/L。
(7)“沉淀”时___(填“能”或“不能”)用Na2SO4溶液代替饱和Na2CO3溶液,原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是 ( )
A.化学键的断裂和形成是化学反应中能量变化的根本原因
B.凡吸热反应均需在加热条件下才能发生
C.等质量的硫蒸气和硫固体分别完全燃烧,前者放出的热量多
D.由图知,红磷比白磷稳定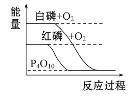
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物燃料电池可净化废水,同时还能获得能源或有价值的化学产品,图1为其工作原理,图2为废水中Cr2O72-离子浓度与去除率的关系。下列说法正确的是
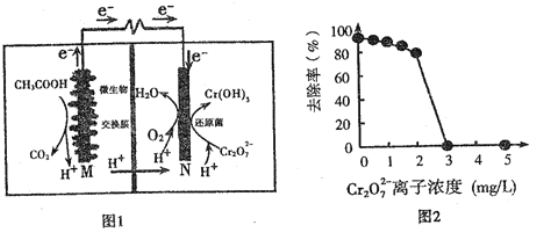
A. M为电池正极,CH3COOH被还原
B. 外电路转移4mol电子时,M 极产生22.4LCO2
C. 反应一段时间后,N极附近的溶液pH下降
D. Cr2O72-离子浓度较大时,可能会造成还原菌失活
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂的一个生产工艺流程如图所示,下列叙述正确的是( )
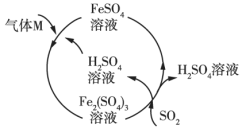
A.该工艺流程是用来制备![]() 的
的
B.气体![]() 是
是![]()
C.气体![]() 参加的反应是化合反应
参加的反应是化合反应
D.![]() 参加反应时氧化剂和还原剂的物质的量之比是
参加反应时氧化剂和还原剂的物质的量之比是![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com