
【题目】某研究性学习小组研究含一定浓度Fe2+的溶液在不同条件下被氧气氧化的氧化率,实验结果如图所示,判断下列说法不正确的是
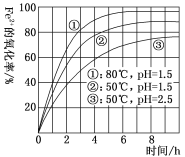
A.温度越高氧化率越大
B.pH越小氧化率越大
C.Fe2+的氧化率仅与溶液的pH和温度有关
D.实验说明降低pH、升高温度有利于提高Fe2+的氧化率
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),按要求回答问题(Cl2易溶于CCl4)。
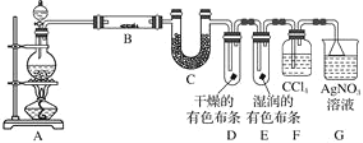
(1)若用含有7.3 g HCl的浓盐酸与足量的MnO2反应制Cl2,制得的Cl2质量总是小于3.55 g的原因是________________________________。
(2)①装置B中盛放的试剂名称为________________,作用是________________________________,现象是_____________________________。
②装置D和E中出现的不同现象说明的问题是___________________。
③装置F的作用是__________________________________________。
(3)乙同学认为甲同学的实验有缺陷,不能确保最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液的气体只有一种,乙同学提出在某两个装置之间再加一个装置。你认为该装置应加在________与________之间(填装置字母序号),装置中应放入________(填写试剂或用品名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(化学——选修3:物质结构与性质)
钴及其化合物在生产中有重要作用,回答下列问题
(1)钴元素基态原子的电子排布式为________________,未成对电子数为________________。
(2)配合物[Co(NH3)4(H2O)2]Cl3是钴重要化合物
①H2O的沸点___ (填“高于”或“低于”)H2S,原因是_______;H2O中O的杂化形式为_____。H2O是_____分子(填“极性”或“非极性”)。
②[Co(NH3)4(H2O)2]Cl3中的Co3+配位数为___。阳离子的立体构型是___________。[Co(NH3)4(H2O)2]Cl3若其中有两个NH3分子被Cl取代,所形成的[Co(NH3)2Cl2(H2O)2]3+的几何异构体种数有(不考虑光学异构)___________种。
(3)一氧化钴的晶胞如图,则在每个Co2+的周围与它最接近的且距离相等的Co2+共有_____个,若晶体中Co2+与O2-的最小距离为acm,则CoO的晶体密度为_______(用含NA和a的代数式表示。结果g/cm3,已知:M(Co)=59g/mol;M(O)=16g/mol,设阿伏加德罗常数为NA)。
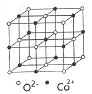
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸铝镁[MgaAlb(OH)c(CO3)d]在一定条件下的转化如下图所示,下列说法正确的是
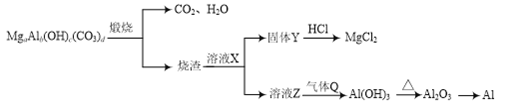
A. a、b、c、d符合关系式:2a+3b=c+2d
B. X可能为NaOH
C. Q可能为NH3
D. 工业上用CO还原Al2O3的方法制取金属Al
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温时通过以下反应制备金属铝。用铝制作的“快速放电铝离子二次电池”的原理如下图所示(EMI+为有机阳离子)。

①Al2O3(s)+AlCl3(g)+3C(s) = 3AlCl(g)+3CO(g) △H1= a kJ·mol-1
②3AlCl(g) = 2Al(l)+ AlCl3(g) △H2= b kJ·mol-1
③Al2O3(s)+3C(s) = 2Al(l)+3CO(g) △H3
下列说法正确的是
A.该电池的电解质可用氯化铝水溶液替代
B.Al2O3(s)+3C(s) = 2Al(l)+3CO(g) △H3= (a-b) kJ·mol-1
C.该电池充电时石墨电极与电源正极相连
D.该电池放电时的负极反应方程式为 :Al-3e-+7AlCl4-=4Al2Cl7-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜及其化合物在工业生产和日常生活中有着广泛的应用。
某化学小组拟采用如下装置(夹持和加热仪器已略去)来测定铜的相对原子质量,同时检验氯气的氧化性。
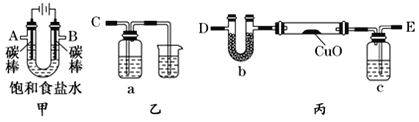
(1)装置甲中发生反应的化学方程式是:__________。
(2)已知装置甲中B处有黄绿色的气体产生,且 B连C ;则A连________(填写连接的字母)。
(3)乙装置的a瓶中溶液可以是________(填标号)
A 酸性KMnO4溶液 B CCl4溶液 C 滴加有KSCN溶液的FeCl2溶液 D 饱和食盐水
(4)在检查装置气密性后,加热丙装置硬质玻璃管里的CuO粉末前,还需要进行的操作为________。
(5)准确称量m g CuO进行实验,当CuO完全反应后测出b中增重n g。则Cu的相对原子质量为____________(只要求列出算式)。该实验方案的装置有不合理之处,若不加以改进会导致测定结果__________ (填“偏大”、“偏小”或“不变”)。
(6)利用焰色反应的原理既可制作五彩缤纷的节日烟花,亦可定性鉴别某些金属盐。灼烧CuCl2样品时,铜的焰色为__________(填标号)。
A 绿色 B 红色 C 紫色 D 黄色
(7)向CuCl2溶液中通人H2S气体,可产生CuS沉淀,反应离子方程式为:Cu2+ + H2S=CuS(s) + 2H+,则该反应的平衡常数K=_________(保留一位小数)。已知:CuS溶度积Ksp=1.0×10-36,H2S电离常数Ka1=1.3×10-7,Ka2=7.0×10-15。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的转化关系如图所示(部分物质和条件已略去)。A、B、E、G、H、J常温下为气体,A为黄绿色,J为红棕色,B能使湿润的红色石蕊试纸变蓝,E是空气中含量最多的气体,C工业上用于制取漂白粉,K为一种红色金属单质,I是常见的无色液体。
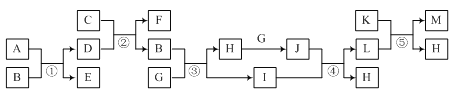
(1)E的化学式为___。
(2)反应②的化学方程式为___。
(3)写出反应③的化学方程式,并用单线桥表示电子转移的方向和数目:___。
(4)反应⑤的离子方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】顺式乌头酸是一种重要的食用增味剂,其结构如下图所示。下列说法正确的是
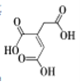
A.该有机物的分子式为:C6H8O6
B.该有机物只含有一种官能团
C.该有机物能使酸性KMnO4溶液、溴的四氯化碳溶液褪色,且原理相同
D.等物质的量的顺式乌头酸分别与足量的NaHCO3和Na反应,产生相同条件下的气体体积之比为2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是以葡萄糖为燃料的微生物燃料电池结构示意图。关于该电池的叙述不正确的是( )
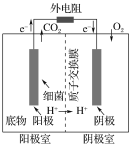
A.该电池不能在高温下工作
B.电池的负极反应为C6H12O6+6H2O-24e-=6CO2↑+24H+
C.放电过程中,电子从正极区向负极区每转移1 mol,便有1 mol H+从阳极室进入阴极室
D.微生物燃料电池具有高能量转换效率、原料较广泛、操作条件温和、有生物相容性等优点,值得研究与推广
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com