
【题目】(化学——选修3:物质结构与性质)
钴及其化合物在生产中有重要作用,回答下列问题
(1)钴元素基态原子的电子排布式为________________,未成对电子数为________________。
(2)配合物[Co(NH3)4(H2O)2]Cl3是钴重要化合物
①H2O的沸点___ (填“高于”或“低于”)H2S,原因是_______;H2O中O的杂化形式为_____。H2O是_____分子(填“极性”或“非极性”)。
②[Co(NH3)4(H2O)2]Cl3中的Co3+配位数为___。阳离子的立体构型是___________。[Co(NH3)4(H2O)2]Cl3若其中有两个NH3分子被Cl取代,所形成的[Co(NH3)2Cl2(H2O)2]3+的几何异构体种数有(不考虑光学异构)___________种。
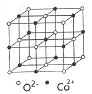
(3)一氧化钴的晶胞如图,则在每个Co2+的周围与它最接近的且距离相等的Co2+共有_____个,若晶体中Co2+与O2-的最小距离为acm,则CoO的晶体密度为_______(用含NA和a的代数式表示。结果g/cm3,已知:M(Co)=59g/mol;M(O)=16g/mol,设阿伏加德罗常数为NA)。
【答案】1s22s22p63s23p63d74s2或[Ar]3d74s2 3 高于 H2O分子间可形成氢键,而H2S分子间无氢键 sp3 极性 6 八面体 5 12 ![]()
【解析】
(1)钴元素为第27号元素,根据构造原理,其基态原子核外的电子排布式为:1s22s22p63s23p63d74s2或[Ar]3d74s2;其3d轨道上有3个未成对电子,故未成对电子数为3;
(2)①H2O的沸点高于H2S,原因是H2O分子间可形成氢键,而H2S分子间无氢键;H2O的中心原子O的成键电子对数为2,未成对电子数为:![]() =2,故氧原子的杂化方式为sp3;H2O的空间结构为V型,其正负电荷中心不重叠,故属于极性分子;
=2,故氧原子的杂化方式为sp3;H2O的空间结构为V型,其正负电荷中心不重叠,故属于极性分子;
②在配合物[Co(NH3)4(H2O)2]Cl3中,配体为NH3、H2O,其配位数=4+2=6;其阳离子的成键电子对数为6,孤电子对数为0,故其立体构型为八面体;若[Co(NH3)4(H2O)2]Cl3其中有两个NH3分子被Cl取代,所形成的[Co(NH3)2Cl2(H2O)2]3+的结构可通过下列方法解答:[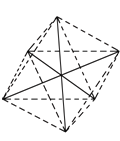 (正八面体构型)],两个NH3分子分别被Cl-和H2O取代,形成[Co(NH3)2Cl2(H2O)2]3+,六个顶点,有三种基团,设为ABC,第一类是相同基团以Co原子为对称中心,不考虑光学异构,只有一种;第二类,以第一种为原型上下顶点不变,只改变正方形,只有一种变化,即原来正方形中的相同基团相邻了,因为有三种基团,所以该类有三种几何异构体;第三类,所有相同的基团都相邻,不考虑光学异构,也只有一种异构体。综上所述,共有5种几何异构体;
(正八面体构型)],两个NH3分子分别被Cl-和H2O取代,形成[Co(NH3)2Cl2(H2O)2]3+,六个顶点,有三种基团,设为ABC,第一类是相同基团以Co原子为对称中心,不考虑光学异构,只有一种;第二类,以第一种为原型上下顶点不变,只改变正方形,只有一种变化,即原来正方形中的相同基团相邻了,因为有三种基团,所以该类有三种几何异构体;第三类,所有相同的基团都相邻,不考虑光学异构,也只有一种异构体。综上所述,共有5种几何异构体;
(3)由CoO的晶胞结构可知,每个Co2+的周围与它最接近的且距离相等的Co2+共有12个;若晶体中Co2+与O2-的最小距离为acm,即该晶胞的边长为2acm,其体积为8a3cm3,该晶胞含有4个CoO“分子”,其质量为![]() g,其密度
g,其密度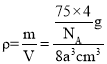 =
=![]() g/cm3。
g/cm3。


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列叙述正确的是( )
A.8.7 g MnO2与40 mL 10 mol·L-1的浓盐酸充分反应,生成的氯气的分子数为0.1NA
B.常温常压下,Cu-Zn原电池中,正极产生1.12 L H2时,转移的电子数应为0.1NA
C.将含3NA个离子的Na2O2固体溶于水配成1 L溶液,所得溶液中Na+的浓度为2 mol·L-1
D.1.0 L 1.0 mol·L-1的NaAlO2水溶液中含有的氧原子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述中正确的是
A.100 mL 0.1 mol·L-1的稀硫酸中含有SO42-个数为0.1NA
B.常温常压下,4 g氦气所含有的中子数为4NA
C.2.7 g金属铝与足量的盐酸反应,铝失去电子数为3NA
D.12.4 g白磷(分子式为P4)中含有磷原子数为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是
A.![]()
B. Al![]() NaAlO2
NaAlO2![]() Al(OH)3
Al(OH)3
C. Fe![]() FeCl2
FeCl2![]() FeCl3
FeCl3
D. Na![]() Na2O
Na2O![]() NaOH
NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,在水槽![]() 中装有
中装有![]() 水,容积为
水,容积为![]() 的试管
的试管![]() 中充满了
中充满了![]() 和
和![]() 的混合气体(标准状况下),将试管
的混合气体(标准状况下),将试管![]() 倒插入水槽
倒插入水槽![]() 中。充分反应后,试管
中。充分反应后,试管![]() 中剩余气体的体积为
中剩余气体的体积为![]() 。
。
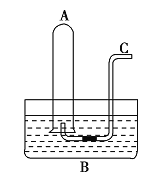
(1)将![]() 倒插入水槽
倒插入水槽![]() 中发生的反应为________________________________________________,该反应中氧化剂与还原剂的质量比为_____________;原混合气体中
中发生的反应为________________________________________________,该反应中氧化剂与还原剂的质量比为_____________;原混合气体中![]() 与
与![]() 的物质的量之比为____________。
的物质的量之比为____________。
(2)通过导气管![]() 向剩余
向剩余![]() 气体的试管
气体的试管![]() 中持续通入氧气,
中持续通入氧气,![]() 中可能观察到的现象是_____________________________________________________________________________________________________。
中可能观察到的现象是_____________________________________________________________________________________________________。
(3)当试管![]() 中充满气体时停止通入氧气,然后将试管从水槽中取出,水槽
中充满气体时停止通入氧气,然后将试管从水槽中取出,水槽![]() 中溶液的物质的量浓度为______
中溶液的物质的量浓度为______![]() (设水槽中液体的体积仍为
(设水槽中液体的体积仍为![]() )。
)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃时,已知PdI2在水中的沉淀溶解平衡曲线如图所示,下列说法正确的是( )
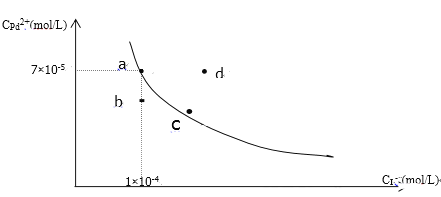
A. 在t℃时PdI2的Ksp=7.0×10-9
B. 图中a点是饱和溶液,b、d两点对应的溶液都是不饱和溶液
C. 向a点的溶液中加入少量NaI固体,溶液由a点向c点方向移动
D. 要使d点移动到b点可以降低温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】光伏材料是指能将太阳能直接转换成电能的材料。光伏材料又称太阳能材料,只有半导体材料具有这种功能。可做太阳电池材料的有单晶硅、多晶硅、非晶硅、GaAs、GaAlAs、InP、CdS、CdTe、CuInSe等。
(1)已知Se在周期表的位置为_____,基态Ga原子核外电子占据的最高能级为_____。
(2)P、S、Ga电负性从大到小的顺序为_____。
(3)与Al元素处于同一主族的硼元素具有缺电子性,其化合物往往具有加合性,因而硼酸(H3BO3)在水溶液中能与水反应生成[B(OH)4]-而体现一元弱酸的性质,[B(OH)4]-的结构式为____(标出配位键)
(4)已知[Cu(H2O)4]2+具有对称的空间构型,[Cu(H2O)4]2+中的2个H2O被Cl-取代,能得到2种不同结构的产物,则[Cu(H2O)4]2+的空间构型为_____。请画出该离子中配位键的结合形式__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组研究含一定浓度Fe2+的溶液在不同条件下被氧气氧化的氧化率,实验结果如图所示,判断下列说法不正确的是
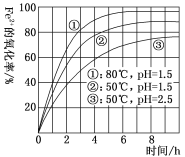
A.温度越高氧化率越大
B.pH越小氧化率越大
C.Fe2+的氧化率仅与溶液的pH和温度有关
D.实验说明降低pH、升高温度有利于提高Fe2+的氧化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E、F6种短周期元素,G为过渡元素;已知相邻的A、B、C、D 4种元素原子核外共有56个电子,在周期表中的位置如图所示。1molE单质与足量酸作用,在标准状况下能产生33.6LH2;E单质粉末与G的氧化物常用于野外焊接钢轨;F是短周期最活泼的金属元素。请回答下列问题:
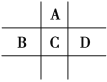
(1)元素D、G的名称分别为:__。
(2)D的单质与C的气态氢化物反应方程式为___。
(3)C、E、A的简单离子半径:__>__>__,B、C、D的最高价氧化物对应的水化物的酸性强弱顺序为___(用化学式表示)。
(4)向D与E形成的化合物的水溶液中滴加过量烧碱溶液的离子方程式为__。
(5)用电子式表示F与C形成化合物的过程___。
(6)G的单质与高温水蒸气反应的方程式___。
(7)部分元素在周期表中的分布如图所示(虚线为金属元素与非金属元素的分界线),下列说法不正确的是___。
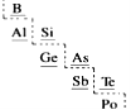
A.B只能得电子,不能失电子 B.原子半径Ge>Si
C.As可作半导体材料 D.Po处于第六周期第VIA族
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com