
| 分子式 | 外观 | 热分解温度 | 熔点 |
| CO(NH2)2•H2O2 | 白色晶体 | 45℃ | 75~85℃ |
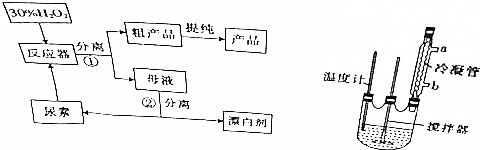
分析 合成过氧化尿素是利用过氧化氢和尿素化合反应生成过氧化尿素,反应的化学方程式为:CO(NH2)2+H2O2=CO(NH2)2•H2O2,经过滤得到CO(NH2)2•H2O2粗产品,母液经分离得到尿素和漂白剂,漂白剂主要含有过氧化氢,
(1)过滤用到的玻璃仪器有漏斗、烧杯和玻璃棒;
(2)过氧化氢和尿素化合反应生成过氧化尿素;
(3)冷凝水应该从下口流入,温度过高,产品易分解;
(4)过氧化氢与Fe、Al反应.
解答 解:合成过氧化尿素是利用过氧化氢和尿素化合反应生成过氧化尿素,反应的化学方程式为:CO(NH2)2+H2O2=CO(NH2)2•H2O2,经过滤得到CO(NH2)2•H2O2粗产品,母液经分离得到尿素和漂白剂,漂白剂主要含有过氧化氢,
(1)流程中操作①是过滤,用到的玻璃仪器有漏斗、烧杯和玻璃棒,故答案为:烧杯;玻璃棒;
(2)过氧化氢和尿素化合反应生成过氧化尿素,反应的化学方程式为:CO(NH2)2+H2O2=CO(NH2)2•H2O2,
故答案为:CO(NH2)2+H2O2=CO(NH2)2•H2O2;
(3)冷凝水应该从下口流入,这样冷凝效果好,故冷凝水从b口流入;CO(NH2)2•H2O2在45℃时发生分解,所以不能用酒精灯直接加热,应该用水浴加热;温度过高,产品易分解,致使活性氧含量降低,
故答案为:b;温度过高,产品易分解,致使活性氧含量降低;
(4)过氧化氢与Fe、Al反应生成三价铁离子,三价铁离子会加速过氧化氢的分解,所以搅拌器不能用铁质、铝质材料的,
故答案为:过氧化氢能氧化铁铝,生成的金属离子能催化过氧化氢的分解.
点评 本题考查了物质制备实验过程分析判断,装置图的理解应用,为高频考点,把握发生的化学反应及实验操作为解答的关键,侧重分析能力及实验能力的考查,注意信息与所学知识的结合,题目难度较大.


 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | NaHS溶液显碱性:HS-+H2O?H3O++S2- | |
| B. | 明矾净水:Al3++3H2O?Al(OH)3(胶体)+3H+ | |
| C. | 制备TiO2纳米粉:TiCl4+(x+2)H2O(过量)?TiO2•xH2O↓+4HCl | |
| D. | 醋酸使碳酸钙溶解:CaCO3+2CH3COOH═Ca 2++2CH3COO-+CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 L0.1mol/L的NaHCO3溶液中含CO32-数目为0.1NA | |
| B. | 含2.3g Na+的Na2O和Na2O2的混合物中,阴离子总数等于0.05 NA | |
| C. | 2.7g铝投入到一定量的稀盐酸中,一定产生0.15NA个H2 | |
| D. | Fe在足量Cl2中燃烧,转移电子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8.4g | B. | 4.2g | C. | 3.6g | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上第一次月考化学卷(解析版) 题型:选择题
现有如下三个热化学方程式:
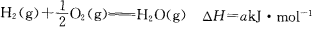
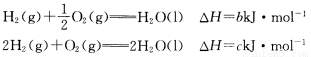
关于它们的下列表述正确的是( )
A.它们都是吸热反应 B.a、b和c均为正值
C.a=b D.2b=c
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 观察(得出Br2物理性质)→实验、观察→预测(推测Br2化学性质)→解释并得出结论 | |
| B. | 预测(推测Br2化学性质)→观察(得出Br2物理性质)→解释并得出结论→实验、观察 | |
| C. | 观察(得出Br2物理性质)→预测(推测Br2化学性质)→实验、观察→解释并得出结论 | |
| D. | 实验、观察→预测(推测Br2化学性质)→观察(得出Br2物理性质)→解释并得出结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
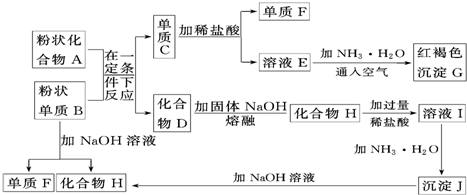
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com