
【题目】互为同位素的微粒是
A. H2 与 D2 B. 氧气与臭氧 C. 35Cl 与 37Cl D. CO 与 CO2
科目:高中化学 来源: 题型:
【题目】某温度时, 在一个2 L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据填空:

(1)该反应的化学方程式为 _____________________________。
(2)反应开始至2 min,以气体Z表示的平均反应速为 ___________________________。
(3)若X、Y、Z均为气体,2 min后反应达到平衡,反应达平衡时:
①此时体系的压强是开始时的_____________倍;
②达平衡时,容器内混合气体的平均相对分子质量比起始投料时 ___(填”增大”“减小”或”相等”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在实验室探究 NaHCO3的性质:常温下,配制0..10 mol·L -1NaHCO3溶液,测其pH为8.4;取少量该溶液滴加CaCl2溶液至pH=7,滴加过程中产生白色沉淀,但无气体放出。下列说法不正确的是
A. NaHCO3溶液呈碱性的原因是HCO3-的水解程度大于电离程度
B. 反应的离子方程式是2HCO3-+Ca2+=CaCO3↓+H2CO3
C. 加入CaCl2促进了HCO3-的水解
D. 反应后的溶液中存在:c(Na+)+2c(Ca2+)=c(HCO3-)+2c(CO32-)+c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工业中氢气可由天然气和水反应制备,其主要反应为:CH4(g)+ 2H2O(g) ![]() CO2(g)+4H2(g) 已知,破坏1mol化学键需要吸收的热量如下表所示:
CO2(g)+4H2(g) 已知,破坏1mol化学键需要吸收的热量如下表所示:
化学键 | C—H | O—H | C=O | H—H |
吸收热量(kJ/mol) | 414 | 464 | 803 | 436 |
试通过计算判断,下列有关甲烷转化成氢气过程的能量变化示意图正确的是
A.  B.
B.  C. C
C. C D.
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从物质A(某正盐)的水溶液出发有下面所示的一系列变化:
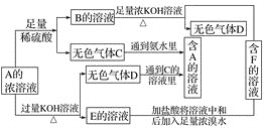
(1)写出A~F物质的化学式:
A__________;B__________;C__________;D__________;E.__________;F__________。
(2)写出E→F的化学方程式______________________________。
(3)鉴别物质F中阴离子的方法是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大气与生态圈的氮循环如图所示,下列叙述不正确的是

A. ④维持大气中氮元素含量稳定
B. ①是野生植物生长所需氮元素的重要来源
C. ⑤为硝化过程、④为反硝化过程,都是氮元素的还原反应过程
D. ②是氮肥工业基础,科学家努力将固氮变化条件趋近生物固氮
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于药物的使用,说法正确的是( )
A.包装上印有“OTC”标志的药品属于处方药
B.药物的服用剂量越大,效果越明显
C.氢氧化铝可作为抑酸剂,治疗胃酸过多
D.阿司匹林是最重要的抗生素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中含有CO、NO、NO2、碳氢化合物等多种污染物。回答下列问题:
(1)汽车燃料中不含氮元素,尾气中所含NO产生的原因是____________________。
(2)已知:2C8H18(1)+25O2(g)=16CO2(g)+18H2O(g) △H1=-10244kJ·mol-1
N2(g)+O2(g)=2NO(g) △H2
2NO(g)+2CO(g)=N2(g)+2CO2(g) △H3=-746kJ·mol-1
①若H2O(1)=H2O(g) △H=+44kJ·mol-1,则表示辛烷燃烧热的热化学方程式为____________________。
②部分化学键键能数据如下:

△H2=__________kJ·mol-1
(3)1573K时,N2+O2![]() 2NO平衡常数为2.0×10-6,若测得内燃机内平衡混合气中氮气、氧气的物质的量分别为0.2mol、0.001mol,则生成NO的物质的量为__________mol,N2的转化率为__________。
2NO平衡常数为2.0×10-6,若测得内燃机内平衡混合气中氮气、氧气的物质的量分别为0.2mol、0.001mol,则生成NO的物质的量为__________mol,N2的转化率为__________。
(4)反应NO(g)+CO(g)=N2(g)+CO2(g)的平衡常数为1.68×1060,从热力学角度看,该反应程度应该很大,实际汽车尾气中该反应的程度很小,原因是____________________,要增大汽车尾气净化装置中单位时间内该反应的程度,关键是要____________________。
(5)T<500K时,反应NO2(g)+CO(g)=NO(g)+CO2(g)分两步进行:
第一步:NO2(g)+NO2(g)→NO3(g)+NO(g) (慢反应)
第二步:NO3(g)+CO(g)→NO(g)+CO2(g) (快反应)
下列表述正确的是__________(填标号)
A.反应速率与NO浓度有关 B.反应速率与NO2浓度有关
C.反应的中间产物只有NO3 D.第二步反应活化能较高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在容积不变的密闭容器中进行如下反应:2X(g)+Y(g)![]() Z(g)+W(s)(正反应为吸热反应),反应一段时间后达到平衡状态。下列叙述正确的是
Z(g)+W(s)(正反应为吸热反应),反应一段时间后达到平衡状态。下列叙述正确的是
A. 加入少量W,逆反应速率增大
B. 通入一定量氦气,压强增大,平衡向正反应方向移动
C. 升高温度,正反应速率增大,逆反应速率减小,平衡向正反应方向移动
D. 降低温度,正反应速率减小,逆反应速率减小,平衡向逆反应方向移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com