
【题目】下列关于药物的使用,说法正确的是( )
A.包装上印有“OTC”标志的药品属于处方药
B.药物的服用剂量越大,效果越明显
C.氢氧化铝可作为抑酸剂,治疗胃酸过多
D.阿司匹林是最重要的抗生素
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列有关糖类、油脂、蛋白质的说法中正确的是( )
A.都只由C、H、O三种元素组成B.都能发生银镜反应
C.都能发生水解反应D.都是食物中的基本营养物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)反应Fe(s)+CO2(g)![]() FeO(s)+CO(g) ΔH1,平衡常数为K1;反应Fe(s)+H2O(g)
FeO(s)+CO(g) ΔH1,平衡常数为K1;反应Fe(s)+H2O(g)![]() FeO(s)+H2(g) ΔH2,平衡常数为K2;在不同温度时K1.K2的值如下表:
FeO(s)+H2(g) ΔH2,平衡常数为K2;在不同温度时K1.K2的值如下表:
700 ℃ | 900 ℃ | |
K1 | 1.47 | 2.15 |
K2 | 2.38 | 1.67 |
①反应CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH的平衡常数为K,则ΔH=_________________(用ΔH1和ΔH2表示),K=________(用K1和K2表示),且由上述计算可知,反应CO2(g)+H2(g)
CO(g)+H2O(g) ΔH的平衡常数为K,则ΔH=_________________(用ΔH1和ΔH2表示),K=________(用K1和K2表示),且由上述计算可知,反应CO2(g)+H2(g)![]() CO(g)+H2O(g)是___________________反应(填“吸热”或“放热”)。
CO(g)+H2O(g)是___________________反应(填“吸热”或“放热”)。
②能判断CO2(g)+H2(g)![]() CO(g)+H2O(g)达到化学平衡状态的依据是_______(填字母)。
CO(g)+H2O(g)达到化学平衡状态的依据是_______(填字母)。
A.容器中压强不变 B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O) D.c(CO)=c(CO2)
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应:Fe(s)+CO2(g)![]() FeO(s)+CO(g) ΔH>0,CO2的浓度与时间的关系如图所示。
FeO(s)+CO(g) ΔH>0,CO2的浓度与时间的关系如图所示。

①用CO表示的化学反应速率为_________________________,该反应平衡常数的表达式为______________________________,该条件下反应的平衡常数为______;若铁粉足量,CO2的起始浓度为2.0 mol·L-1,则平衡时CO2的浓度为______mol·L-1。
②下列措施中能使平衡时![]() 增大的是________(填字母)。
增大的是________(填字母)。
A.升高温度 B.增大压强
C.充入一定量的CO2 D.再加入一定量铁粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组同学利用下图所示装置(夹持及加热装置已略去,装置气密性良好)探究SO2的性质(实验前已事先除去装置中的空气)。请回答下列问题:
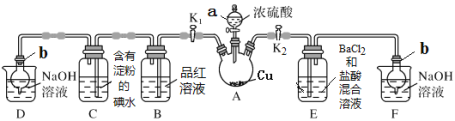
[查阅资料得知浓硫酸的沸点为338 ℃,酒精灯火焰的温度为400~500 ℃]
(1)仪器a的名称_________。
(2)装置D和F的作用是_________。
(3)加热时,装置A中反应的化学方程式为________。
(4)打开K1,关闭K2,加热装置A一段时间后,B中的现象是_____,当装置C中溶液由蓝色变为无色,由此推测所得无色溶液中的离子主要是H+、I- 和____;为了进一步实验证实了该过程中SO2已被氧化,该实验操作及现象是:_____。
(5)关闭K1,打开K2,用酒精灯加热装置A,观察到E中发生的现象是:有白色沉淀产生,白色沉淀的成分是_____,生成白色沉淀的原因可能是___(选填字母序号)。
a.SO2与BaCl2溶液反应生成了白色沉淀
b.BaCl2溶液与硫酸蒸气反应生成了白色沉淀
c.SO2溶于水生成的H2SO3被装置内的O2氧化生成H2SO4,再与BaCl2反应生成白色沉淀
(6)取A中产生的SO2气体通入足量双氧水中,然后加入足量BaCl2溶液,经过滤、洗涤、干燥得到4.66 g沉淀。据此推知SO2气体的体积为___mL(标准状况)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】主族元素W、X、Y、Z的原子序数依次增加,且均不大于20。W、X、Y、Z的族序数之和为12;X与Y的电子层数相同;向过量的ZWY溶液中滴入少量胆矾溶液,观察到既有黑色沉淀生成又有臭鸡蛋气味的气体放出。下列说法正确的是
A. ZWY是离子化合物,其水溶液呈酸性
B. 晶体X熔点高、硬度大,是信息技术的关键材料
C. 原子半径由小到大的顺序为:r(W)<r(X)<r(Y)<r(Z)
D. 最高价氧化物的水化物的酸性:H2XO3<H2YO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(NH4)2Cr2O7用于有机合成催化剂,媒染剂,显影液等。某化学兴趣小组对(NH4)2Cr2O7的部分性质及组成进行探究。已知:Cr2O72-(橙色)+H2O![]() 2CrO42-(黄色)+2H+。回答下列问题:
2CrO42-(黄色)+2H+。回答下列问题:
(1)在试管中加入少量(NH4)2Cr2O7固体,滴加足量浓KOH溶液,振荡、微热,观察到的主要现象是固体溶解、__________、__________。
(2)为探究(NH4)2Cr2O7 (摩尔质量252g/mol)的分解产物,按下图连接好装置,在A中加入5.040g样品进行实验。

①仪器B的名称是__________。
②加热A至恒重,观察到D中溶液不变色,同时测得A、B中质量变化分别为2.00g、1.44g,写出重铬酸铵加热分解反应的化学方程式____________________。
③C的作用是__________。
(3)实验室常用甲醛法测定含(NH4)2Cr2O7的样品中氮的质量分数,其反应原理为:2Ba2++Cr2O72-+H2O=2BaCrO4↓+2H+、 4NH4++6HCHO =3H++6H2O+(CH2)6N4H+[滴定时,1mol(CH2)6N4H+与1molH+相当],然后用NaOH标准溶液滴定反应生成的酸。
实验步骤:称取样品2.800g,配成250mL溶液,移取25.00mL样品溶液于250mL锥形瓶中,用氯化钡溶液使Cr2O72-完全沉淀后,加入10mL20%的中性甲醛溶液,摇匀、静置5min后,加入1~2滴酚酞试液,用0.200 mol·L-1 NaOH标准溶液滴定至终点。重复上述操作3次。
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则滴定时用去NaOH标准溶液的体积__________ (填“偏大”、“偏小”或“无影响”);滴定时边滴边摇动锥形瓶,眼睛应观察__________。
②滴定结果如下表所示
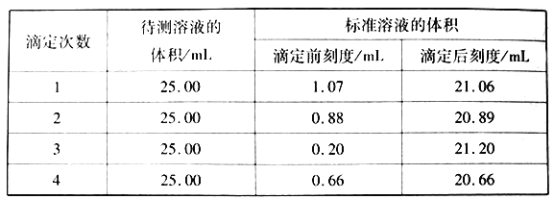
该样品中氮的质量分数为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)1.01×105Pa、0℃时气态单质Xn的密度为d g/L,则X的相对原子质量为________。
(2)NO和O2可发生反应:2NO+O2=2NO2,现有amolNO和bmolO2充分反应后氮原子与氧原子的个数比为_____。
(3)已知铝的相对原子质量为27,若阿伏加德罗常数取6.02×1023mol-1,则可估算一个铝原子的质量约为________g。
(4)设NA为阿伏加德罗常数的数值,如果a g氧气中含有的分子数为b,那么c g氧气在标准状况下的体积约是______(用含NA的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修5:有机化学基础]
诺氟沙星为喹诺酮类抗生素,其合成路线如下:
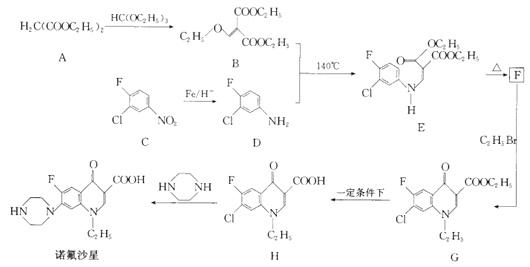
回答下列问题:
(1)化合物A的名称是____________。
(2)诺氟沙星分子中含氧官能团的名称为____________。
(3)C生成D,H生成诺氟沙星的反应类型分别是___________、___________。
(4)F的结构简式为_______________。
(5)G生成H的化学方程式为__________________。
(6)有机物X比B分子少一个CH2原子团,且含有酯基和![]() 结构其中核磁共振氢谱有三组峰,峰面积比为1:3:3的结构简式为__________(任写一种)
结构其中核磁共振氢谱有三组峰,峰面积比为1:3:3的结构简式为__________(任写一种)
(7)参照上述合成路线写出由有机物![]() 、B为有机原料合成
、B为有机原料合成 的路线图______________(无机试剂任选)。
的路线图______________(无机试剂任选)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com