
【题目】(1)反应Fe(s)+CO2(g)![]() FeO(s)+CO(g) ΔH1,平衡常数为K1;反应Fe(s)+H2O(g)
FeO(s)+CO(g) ΔH1,平衡常数为K1;反应Fe(s)+H2O(g)![]() FeO(s)+H2(g) ΔH2,平衡常数为K2;在不同温度时K1.K2的值如下表:
FeO(s)+H2(g) ΔH2,平衡常数为K2;在不同温度时K1.K2的值如下表:
700 ℃ | 900 ℃ | |
K1 | 1.47 | 2.15 |
K2 | 2.38 | 1.67 |
①反应CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH的平衡常数为K,则ΔH=_________________(用ΔH1和ΔH2表示),K=________(用K1和K2表示),且由上述计算可知,反应CO2(g)+H2(g)
CO(g)+H2O(g) ΔH的平衡常数为K,则ΔH=_________________(用ΔH1和ΔH2表示),K=________(用K1和K2表示),且由上述计算可知,反应CO2(g)+H2(g)![]() CO(g)+H2O(g)是___________________反应(填“吸热”或“放热”)。
CO(g)+H2O(g)是___________________反应(填“吸热”或“放热”)。
②能判断CO2(g)+H2(g)![]() CO(g)+H2O(g)达到化学平衡状态的依据是_______(填字母)。
CO(g)+H2O(g)达到化学平衡状态的依据是_______(填字母)。
A.容器中压强不变 B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O) D.c(CO)=c(CO2)
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应:Fe(s)+CO2(g)![]() FeO(s)+CO(g) ΔH>0,CO2的浓度与时间的关系如图所示。
FeO(s)+CO(g) ΔH>0,CO2的浓度与时间的关系如图所示。

①用CO表示的化学反应速率为_________________________,该反应平衡常数的表达式为______________________________,该条件下反应的平衡常数为______;若铁粉足量,CO2的起始浓度为2.0 mol·L-1,则平衡时CO2的浓度为______mol·L-1。
②下列措施中能使平衡时![]() 增大的是________(填字母)。
增大的是________(填字母)。
A.升高温度 B.增大压强
C.充入一定量的CO2 D.再加入一定量铁粉
【答案】△H1-△H2K1/K2吸热BC0.1mol·L-1·min-1k=[CO]/[CO2]2.01.33A
【解析】
(1)①据已知热化学方程式,利用盖斯定律解答;据化学平衡常数表达式分析;
②根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;
(2)①依据平衡常数概念写出,用生成物平衡浓度幂次方乘积除以反应物平衡浓度的幂次方乘积得到平衡常数表达式,代入图上数据即可求K;据K求算二氧化碳的平衡浓度;
②c(CO)/c(CO2)是该反应的平衡常数表达式,平衡常数随温度变化,结合平衡移动原理分析判断.
(1)①已知①反应Fe(s)+CO2(g)![]() FeO(s)+CO(g) ΔH1,平衡常数为K1;②反应Fe(s)+H2O(g)
FeO(s)+CO(g) ΔH1,平衡常数为K1;②反应Fe(s)+H2O(g)![]() FeO(s)+H2(g) ΔH2,平衡常数为K2;据盖斯定律,①-②得:CO2(g)+H2(g)
FeO(s)+H2(g) ΔH2,平衡常数为K2;据盖斯定律,①-②得:CO2(g)+H2(g)![]() CO(g)+H2O(g)△H=△H1-△H2;反应的K=[CO]·[H2O]/[CO2]·[H2],K1=[CO]/[CO2],K2=[H2]/[H2O],所以K=K1/K2;K1随温度的升高而增大,K2随温度升高而减小,则K随温度升高而增大,说明正反应吸热;
CO(g)+H2O(g)△H=△H1-△H2;反应的K=[CO]·[H2O]/[CO2]·[H2],K1=[CO]/[CO2],K2=[H2]/[H2O],所以K=K1/K2;K1随温度的升高而增大,K2随温度升高而减小,则K随温度升高而增大,说明正反应吸热;
②A、反应前后气体体积不变,容器中压强始终不变,故A错误;
B、CO浓度不变,说明各气体浓度都不再变化,反应达到平衡状态,故B正确;
C、v正(H2)=v正(H2O)=v逆(H2O),正逆反应速率相等,但不为0,故C正确;
D、c(CO2)=c(CO)可能是平衡状态,也可能不是,与各物质的初始浓度及转化率有关,故D错误;
故选BC;
(2)①用CO表示的化学反应速率为v(CO)=v(CO2)=(1.5-0.5)mol·L-1/10min=0.1mol·L-1·min-1,该反应平衡常数的表达式为k=[CO]/[CO2]; 据图分析平衡时二氧化碳和CO的浓度分别为0.5mol·L-1和1mol·L-1,K=[CO]/[CO2]=1.0mol·L-1/0.5mol·L-1=2.0;若CO2的起始浓度为2.0mol·L-1,据方程式可知,反应的二氧化碳的浓度与生成CO浓度相等,设为xmol·L-1,则平衡时二氧化碳浓度为(2.0-x)mol·L-1,K=[CO/[CO2]=x/(2.0-x)=2.0,x=4/3=1.33;
②平衡常数随温度变化,不随浓度压强等因素变化,反应是吸热反应,升温平衡时K增大;
A.升高温度,平衡正向进行,平衡常数增大,故A正确;
B.增大压强,平衡不动,平衡常数不变,故B错误;
C.充入一定量CO2,平衡正向进行,但平衡常数不变,故C错误;
D.再加入一定量铁粉,平衡不移动,平衡常数不变,故D错误;
故选A.


科目:高中化学 来源: 题型:
【题目】某矿样中含有大量的 CuS 及少量其他不溶于酸的杂质。实验室中以该矿样为原料制备CuCl2·2H2O 晶体,流程如下:
![]()
(1)在实验室中,欲用 37%(密度为 1.19 g·mL-1)的盐酸配制 500 mL 6 mol·L-1 的盐酸,需要的仪器除 量筒、烧杯、玻璃棒外,还有_____、_____。
(2)①若在实验室中完成系列操作 a。则下列实验操作中,不需要的是____________(填字母)。

②CuCl2 溶液中存在平衡:Cu(H2O)42+(蓝色)+4Cl-![]() CuCl42-(黄色)+4H2O。欲用实验证明滤液 A(绿色)中存在上述平衡,除滤液 A 外,下列试剂中还需要的是_____(填字 母)。
CuCl42-(黄色)+4H2O。欲用实验证明滤液 A(绿色)中存在上述平衡,除滤液 A 外,下列试剂中还需要的是_____(填字 母)。
a.FeCl3 固体 b.CuCl2 固体 c.蒸馏水
(3)某化学小组欲在实验室中研究 CuS 焙烧的反应过程,查阅资料得知在空气中焙烧 CuS 时,固体 质量变化曲线及 SO2 生成曲线如图。

①CuS 矿样在焙烧过程中,有 Cu2S、CuO·CuSO4、CuSO4、CuO 生成,转化顺序为CuS![]() Cu2S
Cu2S![]() CuO·CuSO4
CuO·CuSO4![]() CuSO4
CuSO4![]() CuO第 ① 步 转 化 主 要 在 200 ~ 300 ℃ 内 进 行 , 该 步 转 化 的 化 学 方 程 式______。
CuO第 ① 步 转 化 主 要 在 200 ~ 300 ℃ 内 进 行 , 该 步 转 化 的 化 学 方 程 式______。
②300~400 ℃内,固体质量明显增加的原因是_____,图所示过程中,CuSO4固体能稳定存在的阶段是____________(填字母)。
a.一阶段 b.二阶段 c.三阶段 d.四阶段
③该化学小组设计如下装置模拟 CuS 矿样在氧气中焙烧第四阶段的过程,并验证所得气体为 SO2和 O2 的混合物。

a.装置组装完成后,应立即进行的一项操作是_____。
b.当 D 中产生白色沉淀时,说明第四阶段所得气体为 SO2 和 O2 的混合物,你认为 D 中原来盛有________溶液。
c.若原 CuS 矿样的质量为 10.0 g,实验过程中,保持在 760 ℃左右持续加热,待矿样充分反应后, 石英玻璃管内所得固体的质量为 8.0 g,则原矿样中 CuS 的质量分数为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质转化有关的说法正确的是( )
A.油脂水解的产物是甘油和高级脂肪酸两种产物
B.油脂腐败产生哈喇味是油脂发生了氧化反应
C.蛋白质在体内代谢的最终产物是氨基酸
D.维生素C不是人体的营养物质,不会发生变化而直接排出体外
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在实验室探究 NaHCO3的性质:常温下,配制0..10 mol·L -1NaHCO3溶液,测其pH为8.4;取少量该溶液滴加CaCl2溶液至pH=7,滴加过程中产生白色沉淀,但无气体放出。下列说法不正确的是
A. NaHCO3溶液呈碱性的原因是HCO3-的水解程度大于电离程度
B. 反应的离子方程式是2HCO3-+Ca2+=CaCO3↓+H2CO3
C. 加入CaCl2促进了HCO3-的水解
D. 反应后的溶液中存在:c(Na+)+2c(Ca2+)=c(HCO3-)+2c(CO32-)+c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下的密闭容器中发生如下反应:2M(g)+N(g)![]() 2E(g)。若开始时只充入2 mol E(g),达到化学平衡时,混合气体的压强比开始时增大了20%;若开始时只充入2 mol M(g)和1 mol N(g) 的混合气体,则达到化学平衡时M的转化率是
2E(g)。若开始时只充入2 mol E(g),达到化学平衡时,混合气体的压强比开始时增大了20%;若开始时只充入2 mol M(g)和1 mol N(g) 的混合气体,则达到化学平衡时M的转化率是
A. 20% B. 40%
C. 80% D. 60%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工业中氢气可由天然气和水反应制备,其主要反应为:CH4(g)+ 2H2O(g) ![]() CO2(g)+4H2(g) 已知,破坏1mol化学键需要吸收的热量如下表所示:
CO2(g)+4H2(g) 已知,破坏1mol化学键需要吸收的热量如下表所示:
化学键 | C—H | O—H | C=O | H—H |
吸收热量(kJ/mol) | 414 | 464 | 803 | 436 |
试通过计算判断,下列有关甲烷转化成氢气过程的能量变化示意图正确的是
A.  B.
B.  C. C
C. C D.
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从物质A(某正盐)的水溶液出发有下面所示的一系列变化:
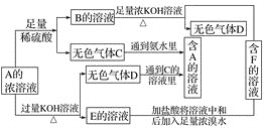
(1)写出A~F物质的化学式:
A__________;B__________;C__________;D__________;E.__________;F__________。
(2)写出E→F的化学方程式______________________________。
(3)鉴别物质F中阴离子的方法是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于药物的使用,说法正确的是( )
A.包装上印有“OTC”标志的药品属于处方药
B.药物的服用剂量越大,效果越明显
C.氢氧化铝可作为抑酸剂,治疗胃酸过多
D.阿司匹林是最重要的抗生素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com