
【题目】某温度下的密闭容器中发生如下反应:2M(g)+N(g)![]() 2E(g)。若开始时只充入2 mol E(g),达到化学平衡时,混合气体的压强比开始时增大了20%;若开始时只充入2 mol M(g)和1 mol N(g) 的混合气体,则达到化学平衡时M的转化率是
2E(g)。若开始时只充入2 mol E(g),达到化学平衡时,混合气体的压强比开始时增大了20%;若开始时只充入2 mol M(g)和1 mol N(g) 的混合气体,则达到化学平衡时M的转化率是
A. 20% B. 40%
C. 80% D. 60%
【答案】D
【解析】
根据等效平衡,在相同温度下,固定容积的反应容器内,2molE与2molM和1molN的物质的量相当,达到平衡时,两者的平衡状态相同,利用三段式解题方法,可求解.
设充入2molE达到平衡状态时反应了2xmolE,根据方程式计算如下:
2M(g)+N(g)![]() 2E(g)
2E(g)
起始 0 mol 0 mol 2mol
转化 2x x 2x
平衡 2x x 2-2x
根据阿伏加德罗定律可知相同条件下气体的物质的量之比等于压强之比,则有:[2x+x+(2-2x)]/2=1.2,解得x=0.4mol;在相同条件下,2molE与2molM和1molN的物质的量相当,达到平衡时,两者的平衡状态相同,即若开始时只充入2molM和1molN的混合气体,达平衡时M的物质的量为0.8mol,转化的M的物质的量为2mol-0.8mol=1.2mol所以达平衡时M的转化率=1.2/2× 100%=60%,
故选D。


科目:高中化学 来源: 题型:
【题目】在2008年初我国南方遭遇的冰雪灾害中,使用了一种融雪剂,其主要成分的化学式为XY2,X、Y均为周期表前20号元素,其阳离子和阴离子的电子层结构相同,且1molXY2含有54mol电子。
(1)该融雪剂的化学式是__________:X与氢元素形成的化合物的电子式是__________。
(2)元素D、E原子的最外层电子数是其电子层数的2倍,D与Y相邻,D与E能形成一种三核分子,该分子的结构式为__________;D所在族元素的氢化物中沸点最低的是__________。
(3)元素R与Y同主族,其氢化物能用于刻蚀玻璃,R2与NaOH溶液反应的产物之一是OR2,该反应的离子方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个体积均为0.5L的恒容密闭容器中发生反应:CO(g)+Cl2(g)![]() COCl2(g)其中容器Ⅰ中5min时到达平衡。
COCl2(g)其中容器Ⅰ中5min时到达平衡。
容器编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | ||
CO | Cl2 | COCl2 | COCl2 | ||
Ⅰ | 500 | 1.0 | 1.0 | 0 | 0.8 |
Ⅱ | 500 | 1.0 | a | 0 | 0.5 |
Ⅲ | 600 | 0.5 | 0.5 | 0.5 | 0.7 |
下列说法正确的是
A. 容器Ⅰ中前5min的中反应速率v(CO)=0.16mol·L-1·min-1
B. 该反应的正反应为吸热反应
C. 容器Ⅱ中起始时Cl2的物质的量为0.55mol
D. 若起始时间容器Ⅰ中加入CO0.8mol、Cl20.8mol,达到平衡时CO的转化率大80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知0.1 mol·L-1的醋酸溶液中存在电离平衡:CH3COOH![]() CH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是
CH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是
A. 加少量烧碱 B. 升高温度
C. 加少量冰醋酸 D. 加CH3COONa固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于蛋白质的叙述正确的是( )
A.加热会使蛋白质变性,因此生吃鸡蛋比熟吃好
B.天然蛋白质中仅含C、H、O、N四种元素
C.鸡蛋清加入食盐,会使蛋白质变性
D.一束光线照射蛋白质溶液,产生丁达尔效应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)反应Fe(s)+CO2(g)![]() FeO(s)+CO(g) ΔH1,平衡常数为K1;反应Fe(s)+H2O(g)
FeO(s)+CO(g) ΔH1,平衡常数为K1;反应Fe(s)+H2O(g)![]() FeO(s)+H2(g) ΔH2,平衡常数为K2;在不同温度时K1.K2的值如下表:
FeO(s)+H2(g) ΔH2,平衡常数为K2;在不同温度时K1.K2的值如下表:
700 ℃ | 900 ℃ | |
K1 | 1.47 | 2.15 |
K2 | 2.38 | 1.67 |
①反应CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH的平衡常数为K,则ΔH=_________________(用ΔH1和ΔH2表示),K=________(用K1和K2表示),且由上述计算可知,反应CO2(g)+H2(g)
CO(g)+H2O(g) ΔH的平衡常数为K,则ΔH=_________________(用ΔH1和ΔH2表示),K=________(用K1和K2表示),且由上述计算可知,反应CO2(g)+H2(g)![]() CO(g)+H2O(g)是___________________反应(填“吸热”或“放热”)。
CO(g)+H2O(g)是___________________反应(填“吸热”或“放热”)。
②能判断CO2(g)+H2(g)![]() CO(g)+H2O(g)达到化学平衡状态的依据是_______(填字母)。
CO(g)+H2O(g)达到化学平衡状态的依据是_______(填字母)。
A.容器中压强不变 B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O) D.c(CO)=c(CO2)
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应:Fe(s)+CO2(g)![]() FeO(s)+CO(g) ΔH>0,CO2的浓度与时间的关系如图所示。
FeO(s)+CO(g) ΔH>0,CO2的浓度与时间的关系如图所示。

①用CO表示的化学反应速率为_________________________,该反应平衡常数的表达式为______________________________,该条件下反应的平衡常数为______;若铁粉足量,CO2的起始浓度为2.0 mol·L-1,则平衡时CO2的浓度为______mol·L-1。
②下列措施中能使平衡时![]() 增大的是________(填字母)。
增大的是________(填字母)。
A.升高温度 B.增大压强
C.充入一定量的CO2 D.再加入一定量铁粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用18mol/L的浓硫酸配制100mL 1mol/L硫酸
(1)① 应取浓硫酸的体积为______mL,用量筒量取浓硫酸缓缓倒入盛水的烧杯中后,___(填“应该”或“不应”)用少量蒸馏水洗涤量筒2~3次并将洗涤溶液也倒入烧杯中。
②若实验仪器有:A.100mL量筒 B.托盘天平 C. 玻璃棒 D. 50mL容量瓶 E. 10mL量筒 F. 胶头滴管 G. 50mL烧杯 H. 100mL容量瓶
实验时应选用的仪器有(填入编号,下同)_______________________。
③定容时,若俯视液面,则所配溶液浓度_______(填“偏高”、“偏低”或“无影响”)
若不小心加水超过了容量瓶刻度线,应_______。
A.用胶头滴管将多余溶液吸出 B.加热容量瓶使水挥发
C.重新配制
(2)在配制一定物质的量浓度的氢氧化钠溶液过程中,下列操作正确的是_______。
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配溶液润洗
C.配制溶液时,把称好的固体药品用适量水溶解后立即转入容量瓶中,加蒸馏水定容
D.定容后,把容量瓶反复上下颠倒摇匀,然后贴上标签备用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组同学利用下图所示装置(夹持及加热装置已略去,装置气密性良好)探究SO2的性质(实验前已事先除去装置中的空气)。请回答下列问题:
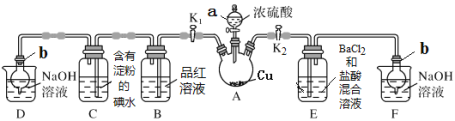
[查阅资料得知浓硫酸的沸点为338 ℃,酒精灯火焰的温度为400~500 ℃]
(1)仪器a的名称_________。
(2)装置D和F的作用是_________。
(3)加热时,装置A中反应的化学方程式为________。
(4)打开K1,关闭K2,加热装置A一段时间后,B中的现象是_____,当装置C中溶液由蓝色变为无色,由此推测所得无色溶液中的离子主要是H+、I- 和____;为了进一步实验证实了该过程中SO2已被氧化,该实验操作及现象是:_____。
(5)关闭K1,打开K2,用酒精灯加热装置A,观察到E中发生的现象是:有白色沉淀产生,白色沉淀的成分是_____,生成白色沉淀的原因可能是___(选填字母序号)。
a.SO2与BaCl2溶液反应生成了白色沉淀
b.BaCl2溶液与硫酸蒸气反应生成了白色沉淀
c.SO2溶于水生成的H2SO3被装置内的O2氧化生成H2SO4,再与BaCl2反应生成白色沉淀
(6)取A中产生的SO2气体通入足量双氧水中,然后加入足量BaCl2溶液,经过滤、洗涤、干燥得到4.66 g沉淀。据此推知SO2气体的体积为___mL(标准状况)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com