
【题目】下列物质转化有关的说法正确的是( )
A.油脂水解的产物是甘油和高级脂肪酸两种产物
B.油脂腐败产生哈喇味是油脂发生了氧化反应
C.蛋白质在体内代谢的最终产物是氨基酸
D.维生素C不是人体的营养物质,不会发生变化而直接排出体外
科目:高中化学 来源: 题型:
【题目】足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO 的混合气体,这些气体与3.36L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5mol/L NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是( )
A. 60mL B. 90mL C. 120mL D. 45mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在63Li 73Li 2311Na 2412Mg 146C 147N中
(1)_______和_______互为同位素
(2)_______和_______的质量数相等,但不能互称同位素
(3)_______和_______的中子数相等,但质子数不等,所以不属于同种元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关糖类、油脂、蛋白质的说法中正确的是( )
A.都只由C、H、O三种元素组成B.都能发生银镜反应
C.都能发生水解反应D.都是食物中的基本营养物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个体积均为0.5L的恒容密闭容器中发生反应:CO(g)+Cl2(g)![]() COCl2(g)其中容器Ⅰ中5min时到达平衡。
COCl2(g)其中容器Ⅰ中5min时到达平衡。
容器编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | ||
CO | Cl2 | COCl2 | COCl2 | ||
Ⅰ | 500 | 1.0 | 1.0 | 0 | 0.8 |
Ⅱ | 500 | 1.0 | a | 0 | 0.5 |
Ⅲ | 600 | 0.5 | 0.5 | 0.5 | 0.7 |
下列说法正确的是
A. 容器Ⅰ中前5min的中反应速率v(CO)=0.16mol·L-1·min-1
B. 该反应的正反应为吸热反应
C. 容器Ⅱ中起始时Cl2的物质的量为0.55mol
D. 若起始时间容器Ⅰ中加入CO0.8mol、Cl20.8mol,达到平衡时CO的转化率大80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作或做法不正确的是
A. 用10 mL量筒量取8.5 mL的水
B. 实验剩余的药品有的可以放回原瓶
C. 把烧杯放在垫有石棉网的铁圈上加热
D. 用燃着的酒精灯去点燃另一酒精灯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知0.1 mol·L-1的醋酸溶液中存在电离平衡:CH3COOH![]() CH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是
CH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是
A. 加少量烧碱 B. 升高温度
C. 加少量冰醋酸 D. 加CH3COONa固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)反应Fe(s)+CO2(g)![]() FeO(s)+CO(g) ΔH1,平衡常数为K1;反应Fe(s)+H2O(g)
FeO(s)+CO(g) ΔH1,平衡常数为K1;反应Fe(s)+H2O(g)![]() FeO(s)+H2(g) ΔH2,平衡常数为K2;在不同温度时K1.K2的值如下表:
FeO(s)+H2(g) ΔH2,平衡常数为K2;在不同温度时K1.K2的值如下表:
700 ℃ | 900 ℃ | |
K1 | 1.47 | 2.15 |
K2 | 2.38 | 1.67 |
①反应CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH的平衡常数为K,则ΔH=_________________(用ΔH1和ΔH2表示),K=________(用K1和K2表示),且由上述计算可知,反应CO2(g)+H2(g)
CO(g)+H2O(g) ΔH的平衡常数为K,则ΔH=_________________(用ΔH1和ΔH2表示),K=________(用K1和K2表示),且由上述计算可知,反应CO2(g)+H2(g)![]() CO(g)+H2O(g)是___________________反应(填“吸热”或“放热”)。
CO(g)+H2O(g)是___________________反应(填“吸热”或“放热”)。
②能判断CO2(g)+H2(g)![]() CO(g)+H2O(g)达到化学平衡状态的依据是_______(填字母)。
CO(g)+H2O(g)达到化学平衡状态的依据是_______(填字母)。
A.容器中压强不变 B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O) D.c(CO)=c(CO2)
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应:Fe(s)+CO2(g)![]() FeO(s)+CO(g) ΔH>0,CO2的浓度与时间的关系如图所示。
FeO(s)+CO(g) ΔH>0,CO2的浓度与时间的关系如图所示。

①用CO表示的化学反应速率为_________________________,该反应平衡常数的表达式为______________________________,该条件下反应的平衡常数为______;若铁粉足量,CO2的起始浓度为2.0 mol·L-1,则平衡时CO2的浓度为______mol·L-1。
②下列措施中能使平衡时![]() 增大的是________(填字母)。
增大的是________(填字母)。
A.升高温度 B.增大压强
C.充入一定量的CO2 D.再加入一定量铁粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(NH4)2Cr2O7用于有机合成催化剂,媒染剂,显影液等。某化学兴趣小组对(NH4)2Cr2O7的部分性质及组成进行探究。已知:Cr2O72-(橙色)+H2O![]() 2CrO42-(黄色)+2H+。回答下列问题:
2CrO42-(黄色)+2H+。回答下列问题:
(1)在试管中加入少量(NH4)2Cr2O7固体,滴加足量浓KOH溶液,振荡、微热,观察到的主要现象是固体溶解、__________、__________。
(2)为探究(NH4)2Cr2O7 (摩尔质量252g/mol)的分解产物,按下图连接好装置,在A中加入5.040g样品进行实验。

①仪器B的名称是__________。
②加热A至恒重,观察到D中溶液不变色,同时测得A、B中质量变化分别为2.00g、1.44g,写出重铬酸铵加热分解反应的化学方程式____________________。
③C的作用是__________。
(3)实验室常用甲醛法测定含(NH4)2Cr2O7的样品中氮的质量分数,其反应原理为:2Ba2++Cr2O72-+H2O=2BaCrO4↓+2H+、 4NH4++6HCHO =3H++6H2O+(CH2)6N4H+[滴定时,1mol(CH2)6N4H+与1molH+相当],然后用NaOH标准溶液滴定反应生成的酸。
实验步骤:称取样品2.800g,配成250mL溶液,移取25.00mL样品溶液于250mL锥形瓶中,用氯化钡溶液使Cr2O72-完全沉淀后,加入10mL20%的中性甲醛溶液,摇匀、静置5min后,加入1~2滴酚酞试液,用0.200 mol·L-1 NaOH标准溶液滴定至终点。重复上述操作3次。
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则滴定时用去NaOH标准溶液的体积__________ (填“偏大”、“偏小”或“无影响”);滴定时边滴边摇动锥形瓶,眼睛应观察__________。
②滴定结果如下表所示
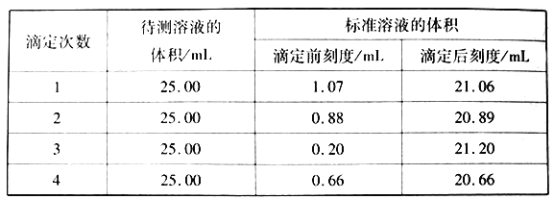
该样品中氮的质量分数为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com