
【题目】足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO 的混合气体,这些气体与3.36L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5mol/L NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是( )
A. 60mL B. 90mL C. 120mL D. 45mL
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分。
碳 | 氮 | Y | |
X | 硫 | Z |
回答下列问题
(1)Z元素在周期表中的位置为__________。
(2)表中元素原子半径最大的是(填元素符号)__________。
(3)下列事实能说明Y元素的非金属性比S元素的非金属性强的是__________;
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molY单质比1molS得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(4)X与Z两元素的单质反应生成1molX的最高价化合物,恢复至室温,放热687kJ,已知该化合物的熔、沸点分别为-69℃和58℃,写出该反应的热化学方程式__________。
(5)碳与镁形成的1mol化合物Q与水反应,生成2molMg(OH)2和1mol烃,该烃分子中碳氢质量比为9:1,烃的电子式为__________。Q与水反应的化学方程式为__________。
(6)铜与一定浓度的硝酸和硫酸的混合酸反应,生成的盐只有硫酸铜,同时生成的两种气体均由表中两种气体组成,气体的相对分子质量都小于50.为防止污染,将产生的气体完全转化为最高价含氧酸盐,消耗1L2.2mol/LNaOH溶液和1molO2,则两种气体的分子式及物质的量分别为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将pH=13的NaOH溶液与pH=2的HCl溶液按1∶9的体积比混合,设混合溶液的总体积为二者相加,则所得混合液的pH值是
A. 11 B. 15 C. 12 D. 7.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 将1.17g氯化钠溶于水,配制成50mL溶液,得到溶液的浓度为0.4mol/L
B. 将1.12L氯化氢气体溶于水,配制成200mL的盐酸溶液,得到溶液的浓度为0.25mol/L
C. 20mL的硫酸溶液中,溶有19.6gH2SO4,此溶液浓度为1mol/L
D. 将40g氢氧化钠溶于2L水中,得到溶液的浓度为0.5mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、R都是中学化学中常见物质,它们均含有同一种短周期元素,在一定条件下可发生如图所示的转化,其中X是单质,Y在常温下是气态氢化物,Z、W是氧化物R是W和水反应的产物。下列判断错误的是( )
![]()
A. X不可能是金属单质 B. Y生成Z属于置换反应
C. Z生成W发生了电子转移 D. Y和R可能会发生反应生成一种盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究NO2、NO、CO等污染物的处理对建设美丽中国具有重要意义。
(1)利用甲烷催化还原NOx:
CH4(g)+4NO2(g) ===4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1
CH4(g)+4NO(g) ===2N2(g)+CO2(g)+2H2O(g) ΔH2=-1160 kJ·mol-1
①甲烷直接将NO2还原为N2的热化学方程式为________________________________。
②将CH4和NO2充入密闭容器中发生上述反应,该反应达到平衡后,为了提高反应速率的同时提高NO2的转化率,可采取的措施有__________(写一点即可)。
③利用原电池反应可实现NO2的无害化,总反应为6NO2+8NH3===7N2+12H2O,电解质溶液为NaOH溶液,工作一段时间后,该电池正极区附近溶液pH________(填“增大”、“减小”或“不变”),负极的电极反应式为___________________。
(2)光气(COCl2)在塑料、制革、制药等工业中有许多用途。工业上常利用废气CO2通过反应:C(s)+CO2(g)![]() 2CO(g) ΔH>0,制取合成光气的原料气CO。在体积可变的恒压(p总)密闭容器中充入1mol CO2 与足量的碳发生上述反应,在平衡时体系中气体体积分数与温度的关系如图所示:
2CO(g) ΔH>0,制取合成光气的原料气CO。在体积可变的恒压(p总)密闭容器中充入1mol CO2 与足量的碳发生上述反应,在平衡时体系中气体体积分数与温度的关系如图所示:
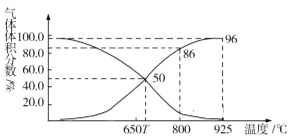
①T℃时,在容器中若充入稀有气体,平衡______移动(填“正向”“逆向”或“不”,下同);若充入等体积的CO2和CO,平衡________移动。
②CO体积分数为40%时,CO2的转化率为_______。
③已知:气体分压(p分)=气体总压×体积分数。800℃时用平衡分压代替平衡浓度表示平衡常数Kp=______(用含p总的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是:( )
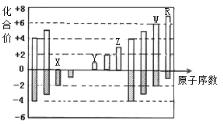
A. 原子半径:Z>Y>X
B. 气态氢化物的稳定性:R>W
C. WX3和水反应形成的化合物是离子化合物
D. Y和Z两者最高价氧化物对应的水化物的碱性:Z>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从石英砂制取并获得高纯硅的主要化学反应如下:
①SiO2+2C![]() Si(粗)+2CO↑
Si(粗)+2CO↑
②Si(粗)+2Cl2![]() SiCl4
SiCl4
③SiCl4+2H2![]() Si(纯)+4HCl
Si(纯)+4HCl
关于上述反应的分析不正确的是( )
A. ①、③是置换反应,②是化合反应
B. 任一反应中,每消耗或生成28 g硅,均转移4 mol电子
C. 高温下,焦炭与氢气的还原性均强于硅
D. 高温下将石英砂、焦炭、氯气、氢气按一定比例混合可得高纯硅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一小块钠投入5mL饱和澄清石灰水中,不可能观察到的现象是( )
A.钠熔成小球并在液面上游动B.有气体生成
C.溶液底部有银白色物质生成D.溶液变浑浊
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com