
【题目】如图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是:( )
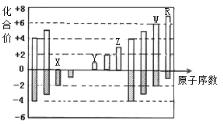
A. 原子半径:Z>Y>X
B. 气态氢化物的稳定性:R>W
C. WX3和水反应形成的化合物是离子化合物
D. Y和Z两者最高价氧化物对应的水化物的碱性:Z>Y
【答案】B
【解析】
由表中化合价可知,X的化合价为-2价,没有正化合价,故X为O元素,Y的化合价为+1价,处于ⅠA族,原子序数大于O元素,故Y为Na元素,Z为+3价,为Al元素,W的化合价为+6、-2价,故W为S元素,R的最高正价为+7价,应为Cl元素,所以X为O,Y为Na,Z为Al,W为S,R为Cl;
A.已知X为O,Y为Na,Z为Al,原子半径应为Na>Al>O,故A错误;
B.已知W为S,R为Cl,非金属性Cl>S,则气态氢化物的稳定性Cl>S,故B正确;
C.X为O,W为S,所以WX3和水反应形成的化合物是硫酸,是共价化合物,故C错误;
D.Z为Al,Y为Na,金属性Na>Al,金属性越强,最高价氧化物对应的水化物碱性越强,则两者最高价氧化物对应的水化物碱性NaOH>Al(OH)3,故D错误;
故选:B。


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】 [物质结构与性质]
臭氧(O3)在[Fe(H2O)6]2+催化下能将烟气中的SO2、NOx分别氧化为![]() 和
和![]() ,NOx也可在其他条件下被还原为N2。
,NOx也可在其他条件下被还原为N2。
(1)![]() 中心原子轨道的杂化类型为___________;
中心原子轨道的杂化类型为___________;![]() 的空间构型为_____________(用文字描述)。
的空间构型为_____________(用文字描述)。
(2)Fe2+基态核外电子排布式为__________________。
(3)与O3分子互为等电子体的一种阴离子为_____________(填化学式)。
(4)N2分子中σ键与π键的数目比n(σ)∶n(π)=__________________。
(5)[Fe(H2O)6]2+与NO反应生成的[Fe(NO)(H2O)5]2+中,NO以N原子与Fe2+形成配位键。请在[Fe(NO)(H2O)5]2+结构示意图的相应位置补填缺少的配体。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知3.6 g碳在6.4 g氧气中燃烧,至反应物耗尽,测得放出热量a kJ。又知12.0 g碳完全燃烧,放出热量为 b kJ。则热化学方程式C(s)+![]() O2(g)===CO(g) ΔH=Q 中Q等于( )
O2(g)===CO(g) ΔH=Q 中Q等于( )
A. -(a-b) kJ·mol-1 B. -(a+b) kJ·mol-1
C. -(5a-0.5b) kJ·mol-1 D. -(10a-b) kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO 的混合气体,这些气体与3.36L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5mol/L NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是( )
A. 60mL B. 90mL C. 120mL D. 45mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(8分)高炉炼铁过程中发生的主要反应为
![]()
已知该反应在不同温度下的平衡常数如下:

请回答下列问题:
(1)该反应的平衡常数表达式K=_____________,△H________0(填“>”、“<”或“=”);
(2)在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,反应经过l0 min后达到平衡。求该时间范围内反应的平均反应速率υ(C02)= _____________、CO的平衡转化率= _____________:
(3)欲提高(2)中CO的平衡转化率,可采取的措施是_____________。
A.减少Fe的量 | B.增加Fe203的量 | C.移出部分C02 |
D.提高反应温度 E.减小容器的容积 F.加入合适的催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有五种化合物:①Mg(HCO3)2,②Al(OH)3,③Al,④(NH4)2CO3,⑤Al2O3。跟盐酸和NaOH溶液都能反应的物质有
A.二种B.三种C.四种D.五种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子一定能在指定溶液中大量共存的是
A. pH=l 的溶液中:Ba2+、Fe3+ 、Cl-、SCN-
B. 能使酚酞变红的溶液:Ca2+、K+、HCO3-、CO32-
C.  =10-12的溶液中:NH4+、Cu2+、NO3-、SO42-
=10-12的溶液中:NH4+、Cu2+、NO3-、SO42-
D. 由水电离的c(H+)=10-12mol·L-1的溶液中:Na+、Al3+、Cl-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某可逆反应:2A(g)![]() B(g)+D(g)在密闭固定容积的容器中4种不同条件下进行,B和D的起始浓度均为0,反应物A的浓度随反应时间的变化情况如下表:
B(g)+D(g)在密闭固定容积的容器中4种不同条件下进行,B和D的起始浓度均为0,反应物A的浓度随反应时间的变化情况如下表:
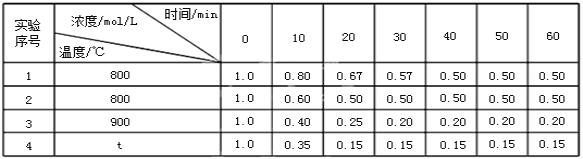
(1)实验1中,在10~20min内,以物质A表示的平均反应速率为_____。
(2)0~20min内,实验2比实验1的反应速率(“快”或“慢”)_____,其原因可能是_____。
(3)实验3比实验1的反应速率(填“快”或“慢”)_____,其原因可能是_____。
(4)从表中可以看出,t_____900(填“>”、“<”、“=”)。
(5)实验3中40分钟时υ(正)_____υ(逆)(填“>”、“<”、“=”)。
(6)实验4中50分钟时B的浓度为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将气体A2、B2各1 mol充入1 L的密闭容器中反应,生成气体C,一段时间后,测得c(A2)为0.58 mol·L-1,c(B2)为0.16 mol·L-1,c(C)为0.84 mol·L-1,则C的化学式为( )
A. AB B. A2B C. AB2 D. A2B2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com