
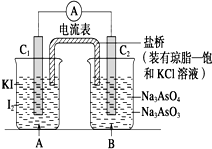
 已知反应AsO${\;}_{4}^{3-}$+2I-+2H+?AsO${\;}_{3}^{3-}$+I2+H2O是可逆反应.设计如图装置
已知反应AsO${\;}_{4}^{3-}$+2I-+2H+?AsO${\;}_{3}^{3-}$+I2+H2O是可逆反应.设计如图装置| A. | 操作Ⅰ过程中,C1为正极 | |
| B. | 操作Ⅱ过程中,盐桥中的K+移向B烧杯溶液 | |
| C. | Ⅰ操作过程中,C2棒上发生的反应为AsO${\;}_{4}^{3-}$+2H++2e-=AsO${\;}_{3}^{3-}$+H2O | |
| D. | Ⅱ操作过程中,C1棒上发生的反应为2I--2e-=I2 |
分析 由图可知,该装置为原电池,Ⅰ、发生AsO43-+2I-+2H+?AsO33-+I2+H2O,C1棒为负极;Ⅱ、发生AsO33-+I2+2OH-?AsO43-+2I-+H2O,C2棒为负极,电子由负极流向正极;
A、操作Ⅰ中发生AsO43-+2I-+2H+?AsO33-+I2+H2O,C1棒为负极;
B、操作II过程中发生AsO33-+I2+2OH-?AsO43-+2I-+H2O,C2棒为负极,电子由负极流向正极,盐桥中的钾离子向A烧杯移动;
C、I操作过程中发生AsO43-+2I-+2H+?AsO33-+I2+H2O,C1棒为负极,发生2I--2e-=I2,C2为正极发生还原反应;
D、AsO32-和I2在水溶液中可以发生自发的氧化还原反应,在原电池的正极上发生得电子的还原反应,负极上失电子发生氧化反应,根据氧化还原反应的生成物来确定现象以及电极方程式.
解答 解:A、操作Ⅰ中发生AsO43-+2I-+2H+?AsO33-+I2+H2O,C1棒为负极,故A错误;
B、操作II过程中发生AsO33-+I2+2OH-?AsO43-+2I-+H2O,C2棒为负极,电子由负极流向正极,盐桥中的钾离子向A烧杯移动,故B错误;
C、I操作过程中发生AsO43-+2I-+2H+?AsO33-+I2+H2O,C1棒为负极,发生2I--2e-=I2,C2为正极发生还原反应,电极反应为AsO42-+2H++2e-=AsO32-+H2O,故C正确;
D、II操作过程中当向B中加入NaOH溶液时,反应AsO43-+2I-+2H+?AsO33-+I2+H2O,逆向进行,C2棒为负极失电子发生电极反应为AsO33-+H2O-2e-=AsO43-+2H+,C1为正极,电极反应为,I2+2e-=2I-,故D错误;
故选C.
点评 本题考查电解池和原电池,明确电解质的不同发生的电池反应不同是解答本题的关键,并熟悉原电池和电解池的工作原理来解答即可,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | $\frac{1}{20}$mol | B. | $\frac{1}{10}$mol | C. | $\frac{1}{5}$mol | D. | $\frac{2}{5}$mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 先生成白色沉淀,加入足量氨水后沉淀消失 | |
| B. | 生成的沉淀为AgCl,它不溶于水,但溶于氨水,重新电离成Ag+和Cl- | |
| C. | 生成的沉淀是AgCl,加入氨水后生成了可溶性的配合物[Ag(NH3)2]Cl | |
| D. | 若向AgNO3溶液中直接滴加氨水,产生的现象也是先出现白色沉淀后沉淀消失 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑥ | B. | ①②④ | C. | ③⑤⑥ | D. | ②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述灼烧过程的尾气回收后可用来制硫酸 | |
| B. | 上述过程中,由6 mol CuFeS2制取6 mol Cu时共消耗15 mol O2 | |
| C. | 在反应2Cu2O+Cu2S═6Cu+SO2↑中,只有Cu2O作氧化剂 | |
| D. | 1200℃灼烧Cu2S得Cu2O而不是CuO,可能是高温下+1价铜更稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol Cl2参加反应转移电子数一定为2NA | |
| B. | 在反应KIO3+6HI═KI+3I2+3H2O中,每生成3 mol I2转移的电子数为6NA | |
| C. | 根据反应中HNO3(稀)$\stackrel{被还原}{→}$NO,而HNO3(浓)$\stackrel{被还原}{→}$NO2可知,氧化性HNO3(稀)>HNO3(浓) | |
| D. | 含有大量NO3-的溶液中,不能同时大量存在H+、Fe2+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在晶体硅中,Si原子与Si-Si键数目比为1:2 | |
| B. | 分子晶体中都存在范德华力,分子内都存在共价键 | |
| C. | HF、HCl、HBr、HI四种物质的沸点依次升高 | |
| D. | 干冰和氯化铵分别受热变为气体所克服的粒子间相互作用属于同种类型 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com