
分析 (1)铝与氢氧化钠溶液反应生成的氢气;
(2)实验设计1:Mg、Al均与盐酸反应,生成H2,体现还原性,根据合金的质量和氢气的体积可求出镁的质量分数;
实验设计2:只有铝与氢氧化钠溶液反应,生成氢气,体现还原性,根据合金的质量和氢气的体积可求出镁的质量分数;
实验设计3:Mg、Al与盐酸反应后,再加入过量NaOH溶液,Mg2+生成Mg(OH)2沉淀,Al3+生成NaAlO2溶液,根据Mg(OH)2沉淀的质量,可求出镁的质量分数;
(3)依据元素守恒计算,合金溶于过量盐酸反应生成氯化镁、氯化铝,加入过量氢氧化钠生成白色沉淀为氢氧化镁,依据镁元素守恒计算镁的质量分数.
解答 解:(1)铝与氢氧化钠溶液反应生成的氢气,反应的离子方程式为:2Al+2NaOH+2H2O═2NaAlO2+3H2↑,故答案为:2Al+2NaOH+2H2O═2NaAlO2+3H2↑;
(2)实验设计1:Mg、Al均与盐酸反应,生成H2,体现还原性,根据合金的质量和氢气的体积可求出镁的质量分数;
实验设计2:只有铝与氢氧化钠溶液反应,生成氢气,体现还原性,根据合金的质量和氢气的体积可求出镁的质量分数;
实验设计3:Mg、Al与盐酸反应后,再加入过量NaOH溶液,Mg2+生成Mg(OH)2沉淀,Al3+生成NaAlO2溶液,根据Mg(OH)2沉淀的质量,可求出镁的质量分数,故答案为:D;
(3)将m g镁铝合金,溶于过量盐酸中,生成氯化镁、氯化铝,再加入过量的NaOH溶液,可得到白色沉淀为氢氧化镁,将此沉淀洗净、干燥后,称得质量为w g,镁元素守恒计算得到n(Mg)=$\frac{wg}{58g/mol}$,合金中镁的质量分数=$\frac{\frac{w}{58}×24g}{mg}$×100%=$\frac{12w}{29m}$×100%,故答案为:$\frac{12w}{29m}$×100%.
点评 本题考查化学实验方案的评价,涉及镁和铝的化学性质、化学实验方案的设计,物质含量测定、化学计算等,难度中等,掌握镁和铝的化学性质是解题的关键.


 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
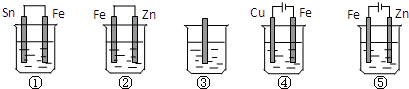
| A. | ①>②>③>④>⑤ | B. | ⑤>①>③>②>④ | C. | ⑤>①>②>③>④ | D. | ⑤>②>①>③>④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 待提纯的物质 | 选用试剂 | 操作的方法 |
| A | FeCl2溶液(FeCl3溶液) | 铁粉 | 过滤 |
| B | Al2O3(Fe2O3) | NaOH溶液和CO2 | 溶解、过滤、过滤 |
| C | Cl2(HCl) | 饱和食盐水 | 洗气 |
| D | Na2CO3固体(NaHCO3固体) | -- | 加热至质量不再变化 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V(H2):V(CO2)=2:1 | B. | V(H2):V(CO2)=1:4 | C. | V(H2):V(CO2)=1:1 | D. | V(H2):V(CO2)=1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去Fe3+中Al3+:加入过量氨水充分反应后,过滤 | |
| B. | 除去FeCl3 中少量CuCl2:用足量的铁粉,过滤 | |
| C. | 除去石英中的碳酸钙:用足量稀盐酸溶解后,过滤 | |
| D. | 除去铝粉中的镁粉:加入足量的氢氧化钠溶液后,过滤 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com