
【题目】已知NaHSO3显酸性,NaHCO3溶液显碱性,现有浓度为0.1mol/L的NaHSO3和NaHCO3两种溶液,两种溶液中各粒子的物质的量浓度存在下列关系(R表示S或C),其中正确的一组是( )
A.c(Na+)>c(HRO3-)>c(H+)>c(RO32-)>c(OH-)
B.c(Na+)+c(H+)=c(HRO3-)+ c(RO32-)+c(OH-)
C.c(H+)+c(H2RO3)=c(RO32-)+c(OH-)
D.c(Na+)=c(HRO3-)+(H2RO3)+2c(RO32-)
【答案】C
【解析】
NaHSO3显酸性,HSO3-+H2O![]() H2SO3+OH-,HSO3-
H2SO3+OH-,HSO3-![]() H++SO32-,HSO3-水解显碱性,电离显酸性,现NaHSO3溶液显酸性,说明HSO3-电离大于水解;而NaHCO3溶液显碱性,说明水解程度大于电离程度。
H++SO32-,HSO3-水解显碱性,电离显酸性,现NaHSO3溶液显酸性,说明HSO3-电离大于水解;而NaHCO3溶液显碱性,说明水解程度大于电离程度。
A、在NaHSO3溶液中,c(H+)>c(OH-),而在NaHCO3中,c(OH-)>c(H+),A不正确;
B、在溶液中,根据电荷守恒有,两溶液中,c(Na+)+c(H+)=c(HRO3-)+ 2c(RO32-)+c(OH-)B不正确;
C、在NaHSO3溶液中,电荷守恒,c(Na+)+c(H+)=c(HSO3-)+ 2c(SO32-)+c(OH-);物料守恒,c(Na+)=c(HSO3-)+ c(SO32-)+ c(H2SO3),联立两式,有c(H+)+c(H2SO3)=c(SO32-)+c(OH-),同理,NaHCO3溶液中也有该等式,C正确;
D、根据物料守恒,两溶液中均有c(Na+)=c(HRO3-)+(H2RO3)+c(RO32-),D不正确;
答案选C。


科目:高中化学 来源: 题型:
【题目】甲同学利用下图所示装置在实验室制备乙酸乙酯
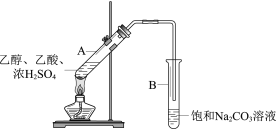
(1)实验中饱和Na2CO3溶液的作用是__________。
(2)分离出试管B中油状液体用到的主要仪器是_________________。
(3)乙醇和乙酸反应制乙酸乙酯是可逆反应。请根据化学平衡移动的相关知识写出一种增大乙酸乙酯产率的方法_________________。
(4)工业上用CH2=CH2和乙酸直接反应获得乙酸乙酯
①其反应类型是____。
②与实验室制法相比,工业制法的优点是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.1mol有机化合物A与标准状况下5.6L氧气混合,一定条件下两者完全反应,只有CO、CO2和H2O三种产物,将全部产物依次通入足量的浓硫酸和碱石灰中,浓硫酸增重5.4克,碱石灰增重4.4克,还有标准状况下2.24L气体的剩余,求:
(1)有机化合物A的分子式_______(要求写出推理过程);
(2)若有机化合物A能与钠反应放出氢气,请写出A的结构简式_________;
(3)写出所有比A多一个—CH2—原子团的同系物的结构简式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁香醛(CH3—![]() —CH2—CHO )是常用的一种食用香精,已知B中含有一个氯原子,各物质之间存在下列转化关系:
—CH2—CHO )是常用的一种食用香精,已知B中含有一个氯原子,各物质之间存在下列转化关系:
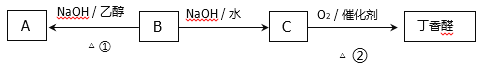
(1)B的分子式为________,C中含氧官能团的名称为________。
(2)反应②的化学方程式为____________________________________。
(3)A发生加聚反应所得产物的结构简式为________________。
(4)与A含有相同官能团的芳香族化合物的同分异构体还有________种(不考虑顺反异构),其中只有一个取代基且不含甲基的物质的结构简式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知煤的部分结构模型如图所示:

(1)我国大约70%的煤是直接用于燃烧的。从煤的结构模型来看,在提供热量的同时产生大量的________等气体物质,造成严重的大气污染。
(2)“型煤”技术不仅可以减少87%的废气排放量,烟尘排放量也可减少80%,致癌物3.4-苯并芘的排放量也减少,同时节煤20%~30%。“型煤”技术的原理是利用固硫剂在燃烧过程中生成稳定的硫酸盐。下列物质中适宜作固硫剂的有________(填字母)。
A.氯化钙 B.氧化钙 C.硫酸钙 D.氢氧化钙
(3)某“型煤”生产厂利用石灰石作固硫剂,试用化学方程式表示其“固硫”过程:_____________________________________________________________。
(4)除上述的“型煤”技术外,为了解决煤燃烧所造成的污染问题和提高煤的利用价值,煤资源的综合利用方法还有________、________、________等。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某地有一池塘,之前生长着丰富的水生生物。近来,由于化工厂将大量污水排入池塘中,使水质恶化,各种水生生物先后死亡。根据题意回答下列问题:
(1)从生态平衡角度看,池塘的这种变化说明了__________________________________,造成这种变化的原因是_____________________________________________________________________。
(2)经检测,污水中溴单质的浓度为![]() ,可用
,可用![]() 除去污水中的溴,发生反应的化学方程式为________________。处理5L这种污水,需加入________L
除去污水中的溴,发生反应的化学方程式为________________。处理5L这种污水,需加入________L![]() 的
的![]() 溶液才能将溴全部除去。
溶液才能将溴全部除去。
(3)要使池塘恢复本来面目,首先要解决的问题是____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜的冶炼过程大致可分为:①富集,对硫化物矿进行浮选;②焙烧,主要反应为 (炉渣);③制粗铜,在1200℃下发生的主要反应为
(炉渣);③制粗铜,在1200℃下发生的主要反应为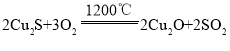 ,
, ;④电解精炼铜。下列说法不正确的是( )
;④电解精炼铜。下列说法不正确的是( )
A.上述焙烧过程的尾气回收后可用来制硫酸
B.上述过程中,由![]()
![]() 制取
制取![]()
![]() 共消耗
共消耗![]()
![]()
C.在反应 中,只有
中,只有![]() 作氧化剂
作氧化剂
D.电解精炼铜时,粗铜应与外接电源的正极相连
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第四周期的Cr、Fe、Co、Ni、Cu、Zn等许多金属能形成配合物,单质铁、砷及它们的化合物广泛应用于超导体材料等领域,请回答下列问题:
(1)Fe2+的核外电子排布式为_________________。
(2)NH3是一种很好的配体,NH3的沸点______(填“>”“=”或“<”)AsH3。
(3)N原子核外有______种不同运动状态的电子。基态N原子中,能量最高的电子所占据的原子轨道的形状为_____。
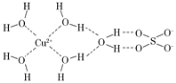
(4)科学家通过X射线测得胆矾结构示意图可简单表示如图,图中虚线表示的作用力为________。
(5)As的卤化物的熔点如下:
AsCl3 | AsBr3 | AsI3 | |
熔点/K | 256.8 | 304 | 413 |
表中卤化物熔点差异的原因是________________。
(6)向FeCl3溶液中滴入EDTA试剂可得配合物A,其结构如图所示,图中M代表Fe3+,则Fe3+与氮原子之间形成的化学键是_______,Fe3+的配位数为______。
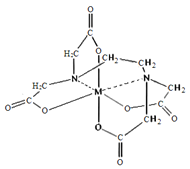
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298K时,用0.1000mol/L NaOH溶液滴定20.00mL同浓度的甲酸溶液过程中溶液pH与NaOH溶液体积的关系如图所示(已知:HCOOH溶液的Ka=l.0×10-4.0)

下列有关叙述正确的是
A. 该滴定过程应该选择甲基橙作为指示剂
B. 图中a、b两点氷的电离程度:b>a
C. 当加入10.00mL NaOH溶液时,溶液中:c(HCOO)>c(H+)>c(Na+)>c(OH)
D. 当加入20.00mL NaOH溶液时,溶液pH>8.0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com