
 2NO2(g)МеПөЦРЈ¬n(NO)ЛжКұјдөДұд»ҜИзұнЈә
2NO2(g)МеПөЦРЈ¬n(NO)ЛжКұјдөДұд»ҜИзұнЈә| Кұјд(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
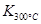 Јҫ
Јҫ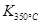 Ј¬ФтёГ·ҙУҰКЗ ИИ·ҙУҰЎЈ
Ј¬ФтёГ·ҙУҰКЗ ИИ·ҙУҰЎЈ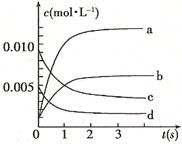
 ЧҙМ¬өДКЗ
ЧҙМ¬өДКЗ  ЎЈ
ЎЈ ёЯР§ЦЗДЬҝОКұЧчТөПөБРҙр°ё
ёЯР§ЦЗДЬҝОКұЧчТөПөБРҙр°ё
| Дкј¶ | ёЯЦРҝОіМ | Дкј¶ | іхЦРҝОіМ |
| ёЯТ» | ёЯТ»Гв·СҝОіМНЖјцЈЎ | іхТ» | іхТ»Гв·СҝОіМНЖјцЈЎ |
| ёЯ¶ю | ёЯ¶юГв·СҝОіМНЖјцЈЎ | іх¶ю | іх¶юГв·СҝОіМНЖјцЈЎ |
| ёЯИэ | ёЯИэГв·СҝОіМНЖјцЈЎ | іхИэ | іхИэГв·СҝОіМНЖјцЈЎ |
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈәІ»Пк МвРНЈәМоҝХМв


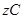 ҙпөҪЖҪәвЈә
ҙпөҪЖҪәвЈә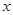 ЎўyЎўzјдөД№ШПөКЗ________________Ј»
ЎўyЎўzјдөД№ШПөКЗ________________Ј»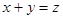 Ј¬ФЪФцҙуС№ЗҝКұЈ¬ИфЖҪәв·ўЙъТЖ¶ҜЈ¬ФтТ»¶ЁПт________ЈЁМоЎ°ХэЎұ»тЎ°ДжЎұЈ©·ҙУҰ·ҪПтТЖ¶ҜЈ»
Ј¬ФЪФцҙуС№ЗҝКұЈ¬ИфЖҪәв·ўЙъТЖ¶ҜЈ¬ФтТ»¶ЁПт________ЈЁМоЎ°ХэЎұ»тЎ°ДжЎұЈ©·ҙУҰ·ҪПтТЖ¶ҜЈ»Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈәІ»Пк МвРНЈәөҘСЎМв
 2CH3OHЈЁgЈ©Ј»ЎчH=37kJЎӨmol-1Ј¬ІвөГ·ҙУҰҙпөҪЖҪәвКұөДУР№ШКэҫЭИзПВЈә
2CH3OHЈЁgЈ©Ј»ЎчH=37kJЎӨmol-1Ј¬ІвөГ·ҙУҰҙпөҪЖҪәвКұөДУР№ШКэҫЭИзПВЈә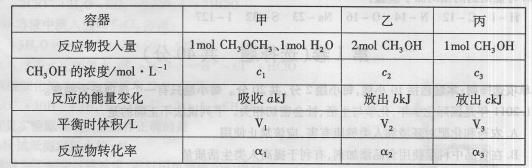
AЈ®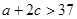 | BЈ®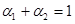 | CЈ®V1=2V3 | DЈ®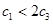 |
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈәІ»Пк МвРНЈәөҘСЎМв
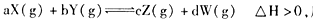 ·ҙУҰ5minҙпөҪЖҪәвКұЈ¬XјхРЎn molЎӨL-1Ј¬УГYұнКҫөД·ҙУҰЛЩВКОӘ0.6n molЎӨL-1ЎӨmin-1ЎЈИфҪ«МеПөС№ЗҝФцҙуЈ¬WөД°Щ·Цә¬БҝІ»·ўЙъұд»ҜЈ¬ФтПВБРГиКцХэИ·өДКЗ ЈЁ Ј©
·ҙУҰ5minҙпөҪЖҪәвКұЈ¬XјхРЎn molЎӨL-1Ј¬УГYұнКҫөД·ҙУҰЛЩВКОӘ0.6n molЎӨL-1ЎӨmin-1ЎЈИфҪ«МеПөС№ЗҝФцҙуЈ¬WөД°Щ·Цә¬БҝІ»·ўЙъұд»ҜЈ¬ФтПВБРГиКцХэИ·өДКЗ ЈЁ Ј©| AЈ®ЙэёЯОВ¶ИЈ¬Хэ·ҙУҰЛЩВКФцҙуЈ¬Дж·ҙУҰЛЩВКјхРЎЈ¬ЖҪәвПтХэ·ҙУҰ·ҪПтТЖ¶Ҝ |
| BЈ®·ҙУҰЦРёчОпЦКөДПөКэұИa:b:c:dҝЙДЬОӘ1Јә3Јә2Јә2 |
| CЈ®ФцҙуXөДЕЁ¶ИЈ¬ЖҪәвПтХэ·ҙУҰ·ҪПтТЖ¶ҜЈ¬XәНYөДЧӘ»ҜВК¶јФцҙу |
| DЈ®ФцҙуС№ЗҝәНК№УГҙЯ»ҜјБ¶јІ»ДЬёДұдёГ·ҙУҰөДЛЩВКәН»ҜС§ЖҪәвЧҙМ¬ |
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈәІ»Пк МвРНЈәМоҝХМв
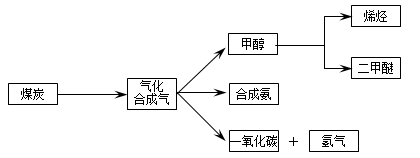
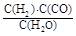 Ј¬ЛьЛщ¶ФУҰ·ҙУҰөД»ҜС§·ҪіМКҪОӘ ЎЈ
Ј¬ЛьЛщ¶ФУҰ·ҙУҰөД»ҜС§·ҪіМКҪОӘ ЎЈ ОВ¶И230Ў«280ЎжЈ©ҪшРРПВБР·ҙУҰЈә
ОВ¶И230Ў«280ЎжЈ©ҪшРРПВБР·ҙУҰЈә CH3OH(g) ЎчH1ЈҪЈӯ90.7kJЎӨmol-1
CH3OH(g) ЎчH1ЈҪЈӯ90.7kJЎӨmol-1 CH3OCH3(g) Ј«H2O(g) ЎчH2ЈҪЈӯ23.5kJЎӨmol-1
CH3OCH3(g) Ј«H2O(g) ЎчH2ЈҪЈӯ23.5kJЎӨmol-1 CO2(g)Ј«H2(g) ЎчH3ЈҪЈӯ41.2kJЎӨmol-1
CO2(g)Ј«H2(g) ЎчH3ЈҪЈӯ41.2kJЎӨmol-1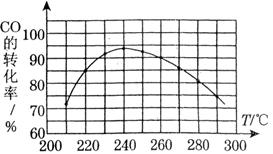
 ЎЈ
ЎЈ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈәІ»Пк МвРНЈәөҘСЎМв
 2NH3 ҰӨHЈј0ЎЈДЬК№әПіЙ°ұ·ҙУҰҪшРРіМ¶ИФцҙуөД·Ҫ·ЁКЗ
2NH3 ҰӨHЈј0ЎЈДЬК№әПіЙ°ұ·ҙУҰҪшРРіМ¶ИФцҙуөД·Ҫ·ЁКЗ| AЈ®ЙэёЯОВ¶И | BЈ®јхөНС№Зҝ |
| CЈ®К№УГҙЯ»ҜјБ | DЈ®ј°Кұ·ЦАліц°ұ |
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈәІ»Пк МвРНЈәөҘСЎМв
 Ј¬ОВ¶И·ЦұрОӘT1әНT2Кұ,XөДЧӘ»ҜВК
Ј¬ОВ¶И·ЦұрОӘT1әНT2Кұ,XөДЧӘ»ҜВК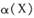 ЛжКұјдұд»ҜөД№ШПөИзУТНјЛщКҫЎЈФтПВБРҪбВЫХэИ·өДКЗ
ЛжКұјдұд»ҜөД№ШПөИзУТНјЛщКҫЎЈФтПВБРҪбВЫХэИ·өДКЗ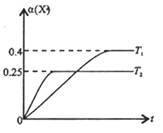
AЈ®ҙпөҪЖҪәвәу,ЖдЛьМхјюІ»ұдЈ¬ҪөөНОВ¶ИЈ¬ ҫщјхРЎЈ¬YөДЧӘ»ҜВК ҫщјхРЎЈ¬YөДЧӘ»ҜВК ТІјхРЎ ТІјхРЎ |
| BЈ®ҙпөҪЖҪәвәу,ЖдЛьМхјюІ»ұдЈ¬НЁИлПЎУРЖшМе»тХЯФцјУMЈ¬ЖҪәвҫщПтДж·ҙУҰ·ҪПтТЖ¶Ҝ |
| CЈ®өұОВ¶ИОӘT2КұЈ¬ИфҝӘКјјУИЛ1 mol X,2mol Y ,2 mol ZәН1mol M,ҙпөҪЖҪәвәуТТөДМе»э·ЦКэФјОӘ16.7% |
DЈ®өұОВ¶ИОӘT1КұЈ¬ИфҝӘКјјУИл1molXЎў2mol YЎў2 mol ZәНa mol M,ҙпөҪЖҪәвәуИфXЎўYЎўZөДОпЦКөДБҝ·ЦКэУлФӯЖҪәвұЈіЦІ»ұдЈ¬ФтУҰВъЧгЈә |
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈәІ»Пк МвРНЈәМоҝХМв
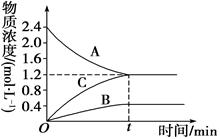
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈәІ»Пк МвРНЈәМоҝХМв
 ИЭ°ьАЁЈә»ҜС§ЖҪәвЎўөзАлЖҪәвЎўЛ®ҪвЖҪәвәН
ИЭ°ьАЁЈә»ҜС§ЖҪәвЎўөзАлЖҪәвЎўЛ®ҪвЖҪәвәН 4C(g) ЎчH>0ҙпөҪЖҪәвКұЈ¬c(A)=2molЈҜLЈ¬c(B)=7molЈҜLЈ¬c(c)
4C(g) ЎчH>0ҙпөҪЖҪәвКұЈ¬c(A)=2molЈҜLЈ¬c(B)=7molЈҜLЈ¬c(c)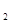 (g)
(g)  2CO(g)ЖҪәвіЈКэKөДұнҙпКҪОӘ Ј»
2CO(g)ЖҪәвіЈКэKөДұнҙпКҪОӘ Ј»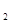 0(g)t
0(g)t CO(g)+H
CO(g)+H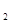 (g)өДЖҪәвіЈКэОӘK1Ј»H
(g)өДЖҪәвіЈКэОӘK1Ј»H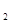 (g)+CO
(g)+CO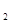 (g)
(g)  C0(g)
C0(g)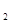 0(g)өДЖҪәвіЈКэОӘҝЦЈ¬ФтK
0(g)өДЖҪәвіЈКэОӘҝЦЈ¬ФтK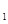 УлK
УлK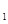 ЎўK
ЎўK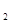 ¶юХЯөД№ШПөОӘ ЎЈ
¶юХЯөД№ШПөОӘ ЎЈ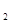 +0
+0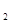
 2S0
2S0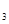 өДЖҪәвіЈКэK=19ЎЈФЪёГОВ¶ИПВөДМе»э
өДЖҪәвіЈКэK=19ЎЈФЪёГОВ¶ИПВөДМе»э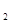 )=lmolЎӨL
)=lmolЎӨL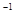 c0(O
c0(O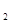 )=1molЎӨL
)=1molЎӨL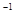 Ј¬өұ·ҙУҰФЪёГОВ¶ИПВSO
Ј¬өұ·ҙУҰФЪёГОВ¶ИПВSO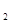 ЧӘ»ҜВК
ЧӘ»ҜВК
 cC(g)+riD(g)ЎчH=
cC(g)+riD(g)ЎчH=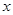 kJЎӨmol
kJЎӨmol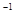 Ј»Иф
Ј»Иф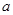 +b>
+b>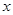 0(МоЎ°>Ўұ»тЎ°<Ўұ)ЎЈ
0(МоЎ°>Ўұ»тЎ°<Ўұ)ЎЈІйҝҙҙр°ёәНҪвОц>>
№ъјКѧУУЕСЎ - Б·П°ІбБРұн - КФМвБРұн
әюұұКЎ»ҘБӘНшОҘ·ЁәНІ»БјРЕПўҫЩұЁЖҪМЁ | НшЙПУРәҰРЕПўҫЩұЁЧЁЗш | өзРЕХ©ЖӯҫЩұЁЧЁЗш | ЙжАъК·РйОЮЦчТеУРәҰРЕПўҫЩұЁЧЁЗш | ЙжЖуЗЦИЁҫЩұЁЧЁЗш
ОҘ·ЁәНІ»БјРЕПўҫЩұЁөз»°Јә027-86699610 ҫЩұЁУКПдЈә58377363@163.com