
����Ŀ��������������(Na2S2O4)�ֳƱ��շۣ��ڷ�֯��ҵ�г����ڻ�ԭȾɫ����
��֪�����������ƾ����������ʣ��ڿ����м��ױ������������ڼ״���������ˮ����ˮѸ�ٷֽ�Ϊ���������ƺ���������ƣ��ڼ��Խ����н��ȶ����ش��������⣺
(1)����������Ʊ�
ԭ�ϣ��������ƹ����70%��Ũ����
(1)�����ٵ�������_______________��
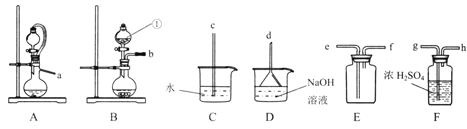
(2)ʵ������ȡ������������װ������˳��Ϊ______��ѡ����ͼ�в���������������������Сд��������ѡ������巢��װ�õ�ԭ����________________��
(3)���ʵ��֤������������л�ԭ��_______��ʵ���п�ѡ�õ��Լ��У�Ʒ����Һ�������ᡢ��ˮ�����з�̪������������Һ��
(��)���շ۵��Ʊ�

I����Gװ���м��������Ũ��Һ���������ƣ��״�(�ܼ�)�Ļ��Һ��
II����K1��K2��һ��ʱ�����װ����ͨ���������
III������һ��ʱ�䣬װ�����л�ɫ�����������������������壻
IV�����ˡ�ϴ�ӡ�����ռ���Ʒ��
(1)д������II���Ʊ����շ۵Ļ�ѧ����ʽ____________��
(2)��������IV���շ۵�ϴ�ӷ����������������У�_________________��
(3) ����IV���ﱣ�շ۵���ѷ���Ϊ________��ѡ����ţ���
A���������������� B���Ȼ����������������� C����ո���
(��)���շ۵ĺ����ⶨ
���軯��ζ���ԭ���ǣ�4K3[Fe(CN)6]+2Na2S2O4+8KOH=3K4[Fe(CN)6]+4Na2SO3+Na4[Fe(CN)6]+4H2O
I����ȡһ��Gװ�ã�����һ�����������������Һ��ͨ��N2��
II����ȡ��Ʒmg����װ��G�н��裬�ܽ⣬�ټ���2-3���Ǽ���ָʾ����
III.��Ũ��Ϊcmol��L-1��K3[Fe(CN)6]�ζ������ζ��յ�ʱ����¼���ĵ����ΪVmL��
���շ�������������ʽΪ__________���ú�c��m��V�Ĵ���ʽ��ʾ����
(2)���ڵζ�ǰδ����ƿ��ͨ��������ᵼ�²ⶨ�ı��շۺ���______���ƫ�ߡ�����ƫ�͡�����Ӱ�족��
���𰸡� ��Һ©�� a��g��h��e��f��d ��װ�ÿ���ƽ��ѹǿ����Ũ����˳�����£� ����������ͨ����ˮ�У���ˮ��ɫ��ȥ����˵������������л�ԭ�� HCOONa+NaOH+2SO2=Na2S2O4��CO2+H2O���������ɣ� ����״���Һ����û���壬���״���Һ˳�����º��ظ�2��3�Ρ���ѡ����ٳ��˲������������ɣ� C ![]() ƫ��
ƫ��
��������(һ)(1)�������������Ƿ�Һ©����
(2)����Aװ���Ʊ�SO2���壬����Fװ�ø��Eװ���ռ���Dװ����NaOH��Һ����β������������Ⱦ�������������װ�õ�����˳��Ϊa��g��h��e��f��d��ѡ��Aװ�ö���ѡ��Bװ�������巢��װ���ǿ��ǵ�Aװ�ÿ���ƽ��ѹǿ����Ũ����˳�����£�
(3)����������ǿ�����Ե���������ˮ�����Ը��������Һ��������л�ԭ�ԣ��ɽ����ڽ���������ͨ����ˮ�У���ˮ��ɫ��ȥ������˵������������л�ԭ�ԣ�
(��)(1)����II��SO2�ڼ�������������HCOONa����CO2��ͬʱ�õ�Na2S2O4��������Ӧ�Ļ�ѧ����ʽΪHCOONa+NaOH+2SO2=Na2S2O4��CO2+H2O��
(2)���Na2S2O4�ڿ����м��ױ������������ڼ״���������ˮ����ˮѸ�ٷֽ�Ϊ���������ƺ���������ƣ��ڼ��Խ����н��ȶ������ʣ�����IV���շ۵�ϴ�ӷ����������������У�����״���Һ����û���壬���״���Һ˳�����º��ظ�2��3�μ��ɣ�
(3)Na2S2O4�ڿ����м��ױ������������ڼ״���������ˮ����ˮѸ�ٷֽ�Ϊ���������ƺ���������ƣ��ڼ��Խ����н��ȶ������ʣ������Ӧ�����������У���ˮ�⣬�ʴ�ΪC��
(��)(1)����K3[Fe(CN)6]�����ʵ���Ϊcmol��L-1��V��10-3L=cV��10-3mol����Na2S2O4�����ʵ���Ϊ0.5cV��10-3mol�����շ�������������ʽΪ![]() ��100%=
��100%=![]() ��
��
(2)���ڵζ�ǰδ����ƿ��ͨ����������������ֹNa2S2O4��������������������ᵼ�²ⶨ�ı��շۺ���ƫ�͡�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У���һ�������¼��ܷ���ˮ�ⷴӦ�����ܷ���������Ӧ���ǣ� ��
A. ����B. ��ѿ��
C. ��������D. ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У������Ų�ʽΪ1s22s22p63s23p6���ǣ� ��
A. Na+B. Mg2 +C. Cl-D. Br-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������β���ǵ���������������ҪԴͷ֮һ���京�е�NO(g)��CO(g)��һ���¶Ⱥʹ��������¿ɷ�����Ӧ��
(һ)��֪����Ӧl: N2(g)+O2(g)=2NO(g) ��H1 K1
��Ӧ2: CO(g)+ 1/2O2(g)=CO2 (g) ��H2 K2
��Ӧ3: 2NO(g)+2C0(g)=N2(g)+CO2(g) ��H3 K3
��Ӧ3���ʱ��H3��_______���á�H1�͡�H2��ʾ�� ƽ�ⳣ��K3=_____(��K1��K2��ʾ����
(��)��1.0L�����ܱ������У�����N2O(g)��C0(g)���ɷ������·�Ӧ��
N2O(g)+C0(g) ![]() N2(g)+CO2(g)������ʵ���������±���
N2(g)+CO2(g)������ʵ���������±���
ʵ���� | �¶�/�� | ��ʼʱ���ʵ���/mol | ƽ��ʱ���ʵ���/mol | |
n(N2O) | n(CO) | n(CO2) | ||
�� | 400 | 0.20 | 0.30 | 0.14 |
�� | 500 | 0.10 | 0.40 | 0.080 |
�� | 500 | 0.30 | 0.20 | A |
�� | 600 | 0.60 | 0.40 | B |
����ʵ���Ţ��У���10minʱ���n(N2)=0.12mol����0��10min�ڣ���CO2��ʾ��ƽ����Ӧ������v(CO2)=________��
(2)500��ʱ����ʹN2O��ƽ��ת����a(N2O)��80%������ʼʱn(N2O):n(CO)��______��
(3)����ʵ���Ţܴ�ƽ��ʱ��b____0.24(�>������<����=��)��ԭ����_______��
(4) N2O(g)+C0(g)![]() N2(g)+CO2(g)�ķ�Ӧ��ϵ�ﵽƽ������ʵ�Ũ���ڲ�ͬ�����µı仯�������ͼ��ʾ��
N2(g)+CO2(g)�ķ�Ӧ��ϵ�ﵽƽ������ʵ�Ũ���ڲ�ͬ�����µı仯�������ͼ��ʾ��

�����ڵ�10min���ı���һ����������20minʱ���������´ﵽ�µ�ƽ��״̬�����10min ʱ�ı������������_______��
�ڱȽ�CO�ڵ�5min�͵�25minʱ���ʵĴ�Сv(5)____v(25)(����>������<����= ��)�����жϵ�������______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������̼̼������˫��������л���ɿ����С�����ṹ�����������ֽṹ���ǣ� ��
A.����ϩ
B.1��3��������ϩ
C.��Ȼ��
D.����Ȳ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼ�ش�����˵��������ǣ�������

A. ���Ӿ���������b�缫
B. ��b������5.4 gʱ��ȼ�ϵ�ظ�������CH4�����Ϊ140 mL
C. ȼ�ϵ����������ӦΪO2��4e����2H2O = 4OH��
D. ��װ�����ڵ����ʱ��һ��ʱ�����������Һ��Ũ�Ȳ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij������ķ���ʽΪC5H11Cl���������ݱ�������������������CH3��������CH2����һ��![]() ��һ����Cl�����Ŀ��ܵĽṹ�м��֣� ��
��һ����Cl�����Ŀ��ܵĽṹ�м��֣� ��
A. 3 B. 4 C. 5 D. 6
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)ijԪ������ϼ�Ϊ��5��ԭ������������Ϊ2���뾶��ͬ������С �ģ����������Ų�ʽΪ______���۵��ӹ���Ϊ______����________��Ԫ�ء�
(2)ijԪ��ԭ�ӵļ۵��ӹ���Ϊ4s24p1�������ڵ�________����________�壬��������ϼ�Ϊ________��Ԫ�ط�����________��
(3)ԭ������Ϊ24��Ԫ��ԭ������________�����Ӳ㣬________���ܼ���________��δ�ɶԵ��ӡ�
(4)��д����2���ܲ��p�����ֻ��һ��δ�ɶԵ��ӵĻ�̬ԭ�ӵ���Χ�����Ų�ͼ(�м���д����)________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com