
【题目】汽车尾气是导致雾霾天气的重要源头之一,其含有的NO(g)和CO(g)在一定温度和催化剂条件下可发生反应。
(一)已知:反应l: N2(g)+O2(g)=2NO(g) △H1 K1
反应2: CO(g)+ 1/2O2(g)=CO2 (g) △H2 K2
反应3: 2NO(g)+2C0(g)=N2(g)+CO2(g) △H3 K3
则反应3的焓变△H3=_______(用△H1和△H2表示) 平衡常数K3=_____(用K1和K2表示)。
(二)向1.0L恒容密闭容器中,充入N2O(g)和C0(g),可发生如下反应:
N2O(g)+C0(g) ![]() N2(g)+CO2(g),所得实验数据如下表:
N2(g)+CO2(g),所得实验数据如下表:
实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
n(N2O) | n(CO) | n(CO2) | ||
① | 400 | 0.20 | 0.30 | 0.14 |
② | 500 | 0.10 | 0.40 | 0.080 |
③ | 500 | 0.30 | 0.20 | A |
④ | 600 | 0.60 | 0.40 | B |
上述实验编号①中,若10min时测得n(N2)=0.12mol,则0至10min内,用CO2表示的平均反应速率以v(CO2)=________;
(2)500℃时,欲使N2O的平衡转化率a(N2O)≥80%,则起始时n(N2O):n(CO)≤______。
(3)上述实验编号④达平衡时,b____0.24(填“>”、“<”或“=”),原因是_______。
(4) N2O(g)+C0(g)![]() N2(g)+CO2(g)的反应体系达到平衡后,各物质的浓度在不同条件下的变化情况如下图所示:
N2(g)+CO2(g)的反应体系达到平衡后,各物质的浓度在不同条件下的变化情况如下图所示:

①若在第10min仅改变了一个条件,第20min时是在条件下达到新的平衡状态,则第10min 时改变的条件可能是_______;
②比较CO在第5min和第25min时速率的大小v(5)____v(25)(填”>”、“<”或“= ”),你判断的理由是______________。
【答案】 2△H2-△H1 ![]() ; 0.012mol·(L·min)-1 l:4 < 该反应△H<O,升高温度,平衡向逆反应方向移动,故b<0.24mol(合理即可) 升温 < 相对于第5min而言,在第10min时升高了温度,且浓度增加了,在其它条件不变时,速率会变快
; 0.012mol·(L·min)-1 l:4 < 该反应△H<O,升高温度,平衡向逆反应方向移动,故b<0.24mol(合理即可) 升温 < 相对于第5min而言,在第10min时升高了温度,且浓度增加了,在其它条件不变时,速率会变快
【解析】(一)已知:① N2(g)+O2(g)=2NO(g) △H1,② CO(g)+ 1/2O2(g)=CO2 (g) △H2,根据盖斯定律可知②×2-①可得2NO(g)+2C0(g)=N2(g)+CO2(g),故△H3=△H2×2-△H1,反应3的焓变△H3=2△H2-△H1 ,平衡常数K3=![]() =
=![]() =
=![]() ;
;
(二)(1)上述实验编号①中,若10min时测得n(N2)=0.12mol,即变化的n(N2)=0.12mol,变化的CO2的物质的量为0.12mol,则0至10min内,用CO2表示的平均反应速率以v(CO2)=  =0.012mol·(L·min)-1;
=0.012mol·(L·min)-1;
(2)500℃时,起始n(N2O)=0.10mol,n(CO)=0.40mol,即n(N2O):n(CO)=1:4时N2O的平衡转化率a(N2O)=80%,增大CO的物质的量平衡正向移动,N2O的转化率会增大,欲使N2O的平衡转化率a(N2O)≥80%,则起始时n(N2O):n(CO)≤1:4;
(3)实验编号① N2O(g)+C0(g) ![]() N2(g)+CO2(g)
N2(g)+CO2(g)
起始时(mol/L) 0.20 0.30 0 0
变化时(mol/L) 0.14 0.14 0.14 0.14
平衡时(mol/L) 0.06 0.16 0.14 0.14
400℃时反应的平衡常数K=![]() =
=![]() =2.04;
=2.04;
实验编号② N2O(g)+C0(g) ![]() N2(g)+CO2(g)
N2(g)+CO2(g)
起始时(mol/L) 0.10 0.40 0 0
变化时(mol/L) 0.08 0.08 0.08 0.08
平衡时(mol/L) 0.02 0.32 0.08 0.08
500℃时反应的平衡常数K=![]() =
=![]() =1<2.04,说明升高温度平衡常数减小,平衡逆向移动,即该反应△H<O;
=1<2.04,说明升高温度平衡常数减小,平衡逆向移动,即该反应△H<O;
实验编号④(500℃) N2O(g)+C0(g) ![]() N2(g)+CO2(g)
N2(g)+CO2(g)
起始时(mol/L) 0.60 0.40 0 0
变化时(mol/L) b b b b
平衡时(mol/L) 0.60-b 0.40-b b b
500℃时反应的平衡常数K=![]() =
=![]() =1,解得b=0.24,即实验编号④在500℃平衡时b=0.24,现温度升高到600℃,该反应△H<O,升高温度,平衡向逆反应方向移动,故b<0.24mol;
=1,解得b=0.24,即实验编号④在500℃平衡时b=0.24,现温度升高到600℃,该反应△H<O,升高温度,平衡向逆反应方向移动,故b<0.24mol;
(4) ①反应物和生成物的浓度瞬间不变,平衡逆向移动,应该是升高温度引起的;
②相对于第5min而言,在第10min时升高了温度,且浓度增加了,在其它条件不变时,速率会变快,即CO在第5min和第25min时速率的大小v(5)<v(25)。


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D为短周期主族元素,25℃时,其最高价氧化物的水化物溶液(浓度均为0.1mol·L-1) 的pH和原子序数的关系如图所示。下列有关说法正确的是

A. 简单离子半径:D离子>C离子>A离子>B离子
B. D元素氧化物的水化物一定是强酸
C. B、C的简单离子都能破坏水的电离平衡
D. 氢化物还原性:C >D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化铈(CeO2)是一种重要的稀土氧化物,平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2、FeO等物质)。某课题组以此粉末为原料,设计如下工艺流程对资源进行回收,得到纯净的CeO2和硫酸铁铵晶体。

已知:CeO2不溶于稀硫酸,也不溶于NaOH溶液。
(1)稀酸A的分子式是_____________________。
(2)滤液1中加入H2O2溶液的目的是__________________。
(3)设计实验证明滤液1中含有Fe2+_____________________。
(4)已知Fe2+溶液可以和难溶于水的FeO(OH)反应生成Fe3O4,书写该反应的离子方程式____________。
(5)由滤液2生成Ce(OH)4的离子方程式__________________。
(6)硫酸铁铵晶体[Fe2(SO4)3·2(NH4)2SO4·3H2O]广泛用于水的净化处理,但其在去除酸性废水中的悬浮物时效率降低,其原因是___________________。
(7)取上述流程中得到的Ce(OH)4产品0.531 g,加硫酸溶解后,用浓度为0.l000mol·L-1FeSO 4标准溶液滴定至终点时(铈被还原为Ce3+ ),消耗25.00 mL标准溶液。该产品中Ce(OH)4的质置分数为_______(结果保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaHS溶液中加入一定量的CuSO4溶液,发生的反应的离子方程式可能为( )
A.S2﹣+Cu2+→CuS↓
B.2HS﹣+Cu2+→CuS↓+2H++S2﹣
C.HS﹣+Cu2+→CuS↓+H+
D.2HS﹣+Cu2+→CuS↓+H2S↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是原子序数依次增大的四种短周期元素,A、B、C、D、F是由其中的两种或三种元素组成的化合物,E是由Z元素形成的单质,0.1molL-1 D溶液的pH为13(25℃)。它们满足如图转化关系,则下列说法正确的是

A. 由X、Y、Z、W四种元素组成的盐溶液pH小于7
B. 化合物F中含有共价键和离子键
C. 0.1molB与足量C完全反应共转移电子数为0.2NA
D. Z元素的最高正价为+6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】连二亚硫酸钠(Na2S2O4)又称保险粉,在纺织行业中常用于还原染色剂。
己知连二亚硫酸钠具有下列性质:在空气中极易被氧化,不溶于甲醇,易溶于水,遇水迅速分解为亚硫酸氢钠和硫代硫酸钠,在碱性介质中较稳定。回答下列问题:
(1)二氧化硫的制备
原料:亚硫酸钠固体和70%的浓硫酸
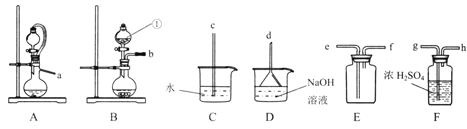
(1)仪器①的名称是_______________。
(2)实验室制取干燥二氧化硫的装置连接顺序为______(选择上图中部分仪器,按气流方向用小写字毋排序),选择该气体发生装置的原因是________________。
(3)设计实验证明二氧化硫具有还原性_______(实验中可选用的试剂有:品红溶液、氢硫酸、溴水,滴有酚酞的氢氧化钠溶液)
(二)保险粉的制备

I.在G装置中加入甲酸钠浓溶液、氢氧化钠,甲醇(溶剂)的混合液;
II:打开K1、K2,一段时间后,向装置中通入二氧化硫;
III.加热一段时间,装置中有黄色晶体析出,并产生大量气体;
IV.过滤、洗涤、干燥,收集产品。
(1)写出步骤II中制备保险粉的化学方程式____________。
(2)简述步骤IV保险粉的洗涤方法:在无氧环境中,_________________。
(3) 步骤IV干燥保险粉的最佳方法为________(选填序号)。
A.空气中蒸发干燥 B.氯化氢气流中蒸发干燥 C.真空干燥
(三)保险粉的含量测定
铁氰化物滴定法原理是:4K3[Fe(CN)6]+2Na2S2O4+8KOH=3K4[Fe(CN)6]+4Na2SO3+Na4[Fe(CN)6]+4H2O
I.另取一套G装置,加入一定体积的氢氧化钠溶液,通入N2;
II.称取样品mg加入装置G中搅拌,溶解,再加入2-3滴亚甲基蓝指示剂;
III.用浓度为cmol·L-1的K3[Fe(CN)6]滴定,至滴定终点时,记录消耗的体积为VmL。
保险粉质量分数表达式为__________(用含c、m、V的代数式表示)。
(2)若在滴定前未向锥形瓶中通氮气,则会导致测定的保险粉含量______(填“偏高”、“偏低”或“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 某有机物燃烧只生成CO2和H2O,且二者物质的量相等,则此有机物的组成为CnH2n
B. 相同质量的烃完全燃烧,消耗O2越多,烃中含H量越高
C. 一种烃在足量的氧气中燃烧并通过浓H2SO4,减少的总体积就是生成的水蒸气的体积
D. 某气态烃CxHy与足量的氧气恰好完全反应,如果反应前后气体体积不变(温度>100),则y=4;若体积减小,则y>4;否则y<4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃、101kP时,甲烷、乙烷和丙烯组成的混合烃32ml,与过量氧气混合并完全燃烧,气体经过浓硫酸干燥,恢复到原来的温度和压强,气体总体积缩小72ml,原混合烃中甲烷、乙烷、丙烯的体积比可能为( )
A. 3:2:1 B. 2:1:2 C. 4:2:5 D. 1:1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活息息相关,下列说法正确的是
A.医用酒精的浓度通常是95%
B.淀粉、油脂和蛋白质都是高分子化合物
C.自行车钢架生锈通常是电化学腐蚀所致
D.煤燃烧产生的烟气直接排放到空气中,易造成水体的富营养化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com