
【题目】二氧化铈(CeO2)是一种重要的稀土氧化物,平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2、FeO等物质)。某课题组以此粉末为原料,设计如下工艺流程对资源进行回收,得到纯净的CeO2和硫酸铁铵晶体。

已知:CeO2不溶于稀硫酸,也不溶于NaOH溶液。
(1)稀酸A的分子式是_____________________。
(2)滤液1中加入H2O2溶液的目的是__________________。
(3)设计实验证明滤液1中含有Fe2+_____________________。
(4)已知Fe2+溶液可以和难溶于水的FeO(OH)反应生成Fe3O4,书写该反应的离子方程式____________。
(5)由滤液2生成Ce(OH)4的离子方程式__________________。
(6)硫酸铁铵晶体[Fe2(SO4)3·2(NH4)2SO4·3H2O]广泛用于水的净化处理,但其在去除酸性废水中的悬浮物时效率降低,其原因是___________________。
(7)取上述流程中得到的Ce(OH)4产品0.531 g,加硫酸溶解后,用浓度为0.l000mol·L-1FeSO 4标准溶液滴定至终点时(铈被还原为Ce3+ ),消耗25.00 mL标准溶液。该产品中Ce(OH)4的质置分数为_______(结果保留两位有效数字)。
【答案】 H2SO4 使Fe2+氧化为Fe3+ 取少许滤液1,滴加铁氰化钾溶液,有蓝色沉淀生成,则证明滤液1中有Fe2+。或其他合理答案 Fe2+ +2FeO(OH) === Fe3O4 +2H+ 4Ce 3 ++ O2 +12OH-+2H2O ==4Ce(OH)4↓ Fe3+ + 3H2O![]() Fe(OH)3 + 3H+,酸性废水抑制Fe3+的水解(或水解平衡逆向移动),使其不能生成有吸附作用的Fe(OH)3胶体 0.98或98%
Fe(OH)3 + 3H+,酸性废水抑制Fe3+的水解(或水解平衡逆向移动),使其不能生成有吸附作用的Fe(OH)3胶体 0.98或98%
【解析】已知CeO2不溶于稀硫酸,也不溶于NaOH溶液,因此玻璃粉末溶于稀硫酸中氧化铁、氧化亚铁溶解得到滤液1,加入双氧水将硫酸亚铁氧化为硫酸铁,然后加入硫酸铵通过蒸发浓缩即可得硫酸铁铵晶体到;二氧化硅和二氧化铈不溶,即滤渣1是二氧化硅和二氧化铈,加入稀硫酸和双氧水,得到Ce3+的溶液,说明二氧化铈和双氧水发生了氧化还原反应,滤渣2是二氧化硅。滤液2中加入氢氧化钠并通入氧气生成Ce(OH)4,加热分解得到二氧化硅。
(1)根据以上分析可知稀酸A是硫酸,的分子式是 H2SO4;(2)滤液1中含有亚铁离子,加入H2O2溶液的目的是使Fe2+氧化为Fe3+;(3)亚铁离子能与铁氰化钾溶液反应产生蓝色沉淀,因此证明滤液1中含有亚铁离子的实验操作是:取少许滤液1,滴加铁氰化钾溶液,有蓝色沉淀生成,则证明滤液1中有Fe2+;(4)已知Fe2+溶液可以和难溶于水的FeO(OH)反应生成Fe3O4,根据电子得失守恒和原子守恒可知该反应的离子方程式为Fe2++2FeO(OH)=Fe3O4 +2H+;(5)由滤液2生成Ce(OH)4的反应物是氢氧化钠、氧气和Ce3+,因此反应的离子方程式为4Ce3++ O2 +12OH-+2H2O=4Ce(OH)4↓;(6)由于Fe3++3H2O![]() Fe(OH)3 + 3H+,酸性溶液中氢离子浓度大,废水抑制Fe3+的水解(或水解平衡逆向移动),使其不能生成有吸附作用的Fe(OH)3胶体,所以效率会降低;(7)根据电子得失守恒可知
Fe(OH)3 + 3H+,酸性溶液中氢离子浓度大,废水抑制Fe3+的水解(或水解平衡逆向移动),使其不能生成有吸附作用的Fe(OH)3胶体,所以效率会降低;(7)根据电子得失守恒可知
Ce(OH)4 ~~~~FeSO4
0.0025mol 0.1000mol/L×0.025L
所以m[Ce(OH)4 ]=0.0025mol×208g/mol=0.52g,产品中Ce(OH)4 的质量分数为![]() 。
。


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:
【题目】下列用系统命名法命名的有机物名称正确的是( )
A. 2 -甲基-4 -乙基戊烷B. 3, 4, 4 -三甲基己烷
C. 2, 3 -二乙基-1 -戊烯D. 1, 2, 4 -三甲基-1 -丁醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】x、y、z三种物质的分子组成分别符合烷烃、烯烃、炔烃的通式,若在一定条件下V L的x、y、z的混合气体可与V L的H2发生加成反应,则混合气体中x、y、z的体积比可能是
A. 1∶1∶1 B. 1∶2∶3 C. 1∶4∶2 D. 3∶2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
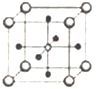
【题目】金属钛性能优越,被誉为继Fe、Al后应用广泛的“第三金属”。
(1)Ti基态原子的电子排布式为____________。
(2)Ti能与B、C、N、O等非金属元素形成稳定的化合物,B、C、N的电负性由大到小的顺序为_____;C、N、O的第一电离能由大到小的顺序为_____________。
(3)N的氢化物常作制冷剂,原因是______________。
(4)月球岩石—玄武岩的主要成分为钛酸亚铁(FeTiO3)。FeTiO3与80%的硫酸反应可生成TiOSO4。
SO42-的空间构型为_______形。其中硫原子采用_________杂化,写出SO42-的一种等电子体的化学式:______。
(5)Ti、Ca、O相互作用能形成如图晶体结构(Ti4+位于立方体的顶点、Ca2+位于立方体体心),该晶体的化学式为________。Ti4+和周围_____个O2-相紧邻。该晶胞的边长为apm,则其密度为______g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,请针对表中所列标号为①~⑩的元素回答下列问题。

(1)非金属性最强的元素是______(填元素符号,下同),形成化合物种类最多的元素是_____,最不活泼的元素是___________。
(2)第三周期元素除⑩外原子半径最小的是______(填元素符号),这些元素的最高价氧化物对应水化物中碱性最强的是__________(填化学式,下同),具有两性的是____________,最高价氧化物对应水化物中酸性最强的是__________。
(3)⑥⑦⑨形成的简单离子的由小到大的顺序是 ______________(用离子符号回答问题),
⑧与⑨对应的氢化物比较稳定的是_________(填化学式)。
(4)⑤和③可以形成两种化合物,其中可以做呼吸面具供氧剂的物质的电子式为_________,所含化学键的类型为 _______________。
(5)①与⑧形成的化合物的结构式 __________,用电子式表示 ⑥与⑨所形成化合物的形成过程 _________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气是导致雾霾天气的重要源头之一,其含有的NO(g)和CO(g)在一定温度和催化剂条件下可发生反应。
(一)已知:反应l: N2(g)+O2(g)=2NO(g) △H1 K1
反应2: CO(g)+ 1/2O2(g)=CO2 (g) △H2 K2
反应3: 2NO(g)+2C0(g)=N2(g)+CO2(g) △H3 K3
则反应3的焓变△H3=_______(用△H1和△H2表示) 平衡常数K3=_____(用K1和K2表示)。
(二)向1.0L恒容密闭容器中,充入N2O(g)和C0(g),可发生如下反应:
N2O(g)+C0(g) ![]() N2(g)+CO2(g),所得实验数据如下表:
N2(g)+CO2(g),所得实验数据如下表:
实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
n(N2O) | n(CO) | n(CO2) | ||
① | 400 | 0.20 | 0.30 | 0.14 |
② | 500 | 0.10 | 0.40 | 0.080 |
③ | 500 | 0.30 | 0.20 | A |
④ | 600 | 0.60 | 0.40 | B |
上述实验编号①中,若10min时测得n(N2)=0.12mol,则0至10min内,用CO2表示的平均反应速率以v(CO2)=________;
(2)500℃时,欲使N2O的平衡转化率a(N2O)≥80%,则起始时n(N2O):n(CO)≤______。
(3)上述实验编号④达平衡时,b____0.24(填“>”、“<”或“=”),原因是_______。
(4) N2O(g)+C0(g)![]() N2(g)+CO2(g)的反应体系达到平衡后,各物质的浓度在不同条件下的变化情况如下图所示:
N2(g)+CO2(g)的反应体系达到平衡后,各物质的浓度在不同条件下的变化情况如下图所示:

①若在第10min仅改变了一个条件,第20min时是在条件下达到新的平衡状态,则第10min 时改变的条件可能是_______;
②比较CO在第5min和第25min时速率的大小v(5)____v(25)(填”>”、“<”或“= ”),你判断的理由是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫及其化合物广泛存在于自然界中。
(1)四硫富瓦烯分子结构如图所示,其碳原子杂化轨道类型为_________,根据电子云的重叠方式其含有的共价键类型为___________,1mol四硫富瓦烯中含有σ键数目为__________。

(2)煅烧硫铁矿时发生的反应为FeS2+O2![]() Fe2O3+SO2,所得产物SO2再经催化氧化生成SO3,SO3被水吸收生成硫酸。
Fe2O3+SO2,所得产物SO2再经催化氧化生成SO3,SO3被水吸收生成硫酸。
①基态S原子存在____________对自旋方向相反的电子。
②离子化合物FeS2中,Fe2+的电子排布式为__________,与S22-互为电子体的离子是____________。
③气体SO3分子的空间构型为__________,中心原子阶层电子对数为____________。
(3)闪锌矿是一种自然界含Zn元素的矿物,其晶体结构属于立方晶体(如下图所示),Zn属于_______区元素,在立方ZnS晶体结构中S2-的配位数为______________,若立方ZnS晶体的密度为ρg·cm-3,晶胞参数a=______nm(列出计算式),晶胞中A、B的坐标分别为A(![]() ,
, ![]() ,
, ![]() )、B(
)、B(![]() ,
, ![]() ,
, ![]() ),则C点的坐标为____________。
),则C点的坐标为____________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com