
【题目】x、y、z三种物质的分子组成分别符合烷烃、烯烃、炔烃的通式,若在一定条件下V L的x、y、z的混合气体可与V L的H2发生加成反应,则混合气体中x、y、z的体积比可能是
A. 1∶1∶1 B. 1∶2∶3 C. 1∶4∶2 D. 3∶2∶1
科目:高中化学 来源: 题型:
【题目】铝及其化合物在日常生活、工业上有广泛的应用。
(1)铝原子核外有_____种不同运动状态的电子,有_____种能量不同的电子。
(2)氮化铝具有强度高,耐磨,抗腐蚀,熔点可达2200℃。推测氮化铝是______晶体,试比较组成该物质的两微粒半径大小____________________。
(3)可用铝和氧化钡反应可制备金属钡:2Al+4BaO![]() 3Ba↑+BaO·Al2O3的主要原因是 __________ (选填编号)。
3Ba↑+BaO·Al2O3的主要原因是 __________ (选填编号)。
a.Al活泼性大于Ba | b.Ba沸点比Al的低 | c.BaO·Al2O3比Al2O3稳定 |
(4)氢氧化铝在水中发生酸式电离的电离方程式为:____________________,
滴入少量盐酸,上述体系中Al3+浓度_______(填“增加”、“减少”或“不变”)。
(5)工业上用氢氧化铝、氢氟酸和碳酸钠制取冰晶石(Na3AlF6)。其反应物中有两种元素在周期表中位置相邻,可比较它们金属性或非金属性强弱的是_______ (选填编号)。
a.气态氢化物的稳定性
b.最高价氧化物对应水化物的酸(碱)性
c.单质与氢气反应的难易
d.单质与同浓度酸发生反应的快慢
(6)冰晶石可做电解氧化铝的助熔剂,此反应中若有0.6mol电子转移,则在________极可得金属铝的质量为__________克。工业上不用电解氯化铝而是用电解氧化铝的方法获得铝单质的原因_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D为短周期主族元素,25℃时,其最高价氧化物的水化物溶液(浓度均为0.1mol·L-1) 的pH和原子序数的关系如图所示。下列有关说法正确的是

A. 简单离子半径:D离子>C离子>A离子>B离子
B. D元素氧化物的水化物一定是强酸
C. B、C的简单离子都能破坏水的电离平衡
D. 氢化物还原性:C >D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】法医常用马氏试砷法检验是否砒霜( As2O3)中毒,涉及的反应如下:
I:6Zn+As2O3+12HCl=6ZnCl2+2AsH3(砷烷)↑+3H2O
Ⅱ:2AsH3=2As(黑色砷镜)+3H2
(1)写出砷的基态原子价电子排布图______________。
(2)砷烷的空间结构为_______;砷烷中心原子杂化方式为________。
(3)砷烷同族同系列物质相关性质如下表:
NH3 | PH3 | AsH3 | SbH3 | |
熔点/℃ | -77.8 | -133.5 | -116.3 | -88 |
沸点/℃ | -34.5 | -87.5 | -62.4 | -18.4 |
从PH3→AsH3→SbH3熔沸点依次升高的原因是_________;NH3分子例外的原因是_______。
(4)第一电离能数据I(As)>I(Se),可能的原因是_____________。
(5)砷与铟(In)形成的化合物(X)具有优良的光电性能,广泛应用于光纤通信用激光器,其晶胞结构如图所示,则其化学式为______;晶胞边长a= 666.67pm,则其密度为_____g/cm3(边长a可用![]() 近似计算,设NA=6.0×1023/mol)。
近似计算,设NA=6.0×1023/mol)。
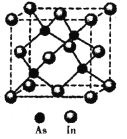
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验能达到预期目的的是
A. 用溴水检验汽油中是否含有不饱和脂肪烃
B. 除去苯中混有的苯酚,加入浓溴水,过滤
C. 除去乙醇中混有的水,加入金属钠,蒸馏
D. 乙烷气体中混有乙烯, 通入酸性高锰酸钾溶液,洗气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化铈(CeO2)是一种重要的稀土氧化物,平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2、FeO等物质)。某课题组以此粉末为原料,设计如下工艺流程对资源进行回收,得到纯净的CeO2和硫酸铁铵晶体。

已知:CeO2不溶于稀硫酸,也不溶于NaOH溶液。
(1)稀酸A的分子式是_____________________。
(2)滤液1中加入H2O2溶液的目的是__________________。
(3)设计实验证明滤液1中含有Fe2+_____________________。
(4)已知Fe2+溶液可以和难溶于水的FeO(OH)反应生成Fe3O4,书写该反应的离子方程式____________。
(5)由滤液2生成Ce(OH)4的离子方程式__________________。
(6)硫酸铁铵晶体[Fe2(SO4)3·2(NH4)2SO4·3H2O]广泛用于水的净化处理,但其在去除酸性废水中的悬浮物时效率降低,其原因是___________________。
(7)取上述流程中得到的Ce(OH)4产品0.531 g,加硫酸溶解后,用浓度为0.l000mol·L-1FeSO 4标准溶液滴定至终点时(铈被还原为Ce3+ ),消耗25.00 mL标准溶液。该产品中Ce(OH)4的质置分数为_______(结果保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 某有机物燃烧只生成CO2和H2O,且二者物质的量相等,则此有机物的组成为CnH2n
B. 相同质量的烃完全燃烧,消耗O2越多,烃中含H量越高
C. 一种烃在足量的氧气中燃烧并通过浓H2SO4,减少的总体积就是生成的水蒸气的体积
D. 某气态烃CxHy与足量的氧气恰好完全反应,如果反应前后气体体积不变(温度>100),则y=4;若体积减小,则y>4;否则y<4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com