
【题目】A、B、C、D为短周期主族元素,25℃时,其最高价氧化物的水化物溶液(浓度均为0.1mol·L-1) 的pH和原子序数的关系如图所示。下列有关说法正确的是

A. 简单离子半径:D离子>C离子>A离子>B离子
B. D元素氧化物的水化物一定是强酸
C. B、C的简单离子都能破坏水的电离平衡
D. 氢化物还原性:C >D
科目:高中化学 来源: 题型:
【题目】为了减少大气污染,许多城市推广汽车使用清洁燃料。目前使用的清洁燃料主要有两类,一类是压缩天然气(CNG),另一类是液化石油气(LPG)。这两类燃料的主要成分都是( )。
A.碳水化合物B.碳氢化合物C.氢气D.醇类
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列用系统命名法命名的有机物名称正确的是( )
A. 2 -甲基-4 -乙基戊烷B. 3, 4, 4 -三甲基己烷
C. 2, 3 -二乙基-1 -戊烯D. 1, 2, 4 -三甲基-1 -丁醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为完成相应实验,实验器材(规格和数量不限)足够的一项是
相应实验 | 实验器材(省略夹持装置) | |
A | 氯化钠溶液的浓缩结晶 | 烧杯、玻璃棒、酒精灯 |
B | 用盐酸除去硫酸钡中的少量碳酸钡 | 烧杯、漏斗、胶头滴管、滤纸 |
C | 用浓硫酸配制0.5mol·L-1的溶液 | 烧杯、玻璃棒、胶头滴管、容量瓶 |
D | 用溴水和CCl4除去NaBr溶液中的少量NaI | 烧杯、玻璃棒、胶头滴管、分液漏斗 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E均为有机物,其中A是化学实验中最常见的有机物,它易溶于水并有特殊香味;B的产量可衡量一个国家石油化工发展的水平,有关物质的转化关系如图甲所示:
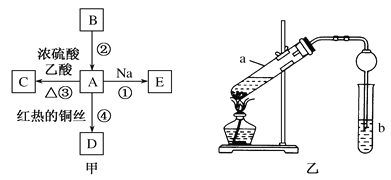
(1)写出B的结构简式___________;A中官能团的名称为_______________。
(2)写出反应①的化学方程式:_____________________________________;
反应②的反应类型是______________。
(3)实验室利用反应③制取C,常用上图乙装置:
①a试管中的主要化学反应的方程式为___________________________。
反应类型是__________________。
②在实验中球形干燥管除起冷凝作用外,另一个重要作用是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】x、y、z三种物质的分子组成分别符合烷烃、烯烃、炔烃的通式,若在一定条件下V L的x、y、z的混合气体可与V L的H2发生加成反应,则混合气体中x、y、z的体积比可能是
A. 1∶1∶1 B. 1∶2∶3 C. 1∶4∶2 D. 3∶2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气是导致雾霾天气的重要源头之一,其含有的NO(g)和CO(g)在一定温度和催化剂条件下可发生反应。
(一)已知:反应l: N2(g)+O2(g)=2NO(g) △H1 K1
反应2: CO(g)+ 1/2O2(g)=CO2 (g) △H2 K2
反应3: 2NO(g)+2C0(g)=N2(g)+CO2(g) △H3 K3
则反应3的焓变△H3=_______(用△H1和△H2表示) 平衡常数K3=_____(用K1和K2表示)。
(二)向1.0L恒容密闭容器中,充入N2O(g)和C0(g),可发生如下反应:
N2O(g)+C0(g) ![]() N2(g)+CO2(g),所得实验数据如下表:
N2(g)+CO2(g),所得实验数据如下表:
实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
n(N2O) | n(CO) | n(CO2) | ||
① | 400 | 0.20 | 0.30 | 0.14 |
② | 500 | 0.10 | 0.40 | 0.080 |
③ | 500 | 0.30 | 0.20 | A |
④ | 600 | 0.60 | 0.40 | B |
上述实验编号①中,若10min时测得n(N2)=0.12mol,则0至10min内,用CO2表示的平均反应速率以v(CO2)=________;
(2)500℃时,欲使N2O的平衡转化率a(N2O)≥80%,则起始时n(N2O):n(CO)≤______。
(3)上述实验编号④达平衡时,b____0.24(填“>”、“<”或“=”),原因是_______。
(4) N2O(g)+C0(g)![]() N2(g)+CO2(g)的反应体系达到平衡后,各物质的浓度在不同条件下的变化情况如下图所示:
N2(g)+CO2(g)的反应体系达到平衡后,各物质的浓度在不同条件下的变化情况如下图所示:

①若在第10min仅改变了一个条件,第20min时是在条件下达到新的平衡状态,则第10min 时改变的条件可能是_______;
②比较CO在第5min和第25min时速率的大小v(5)____v(25)(填”>”、“<”或“= ”),你判断的理由是______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com