
【题目】硫及其化合物广泛存在于自然界中。
(1)四硫富瓦烯分子结构如图所示,其碳原子杂化轨道类型为_________,根据电子云的重叠方式其含有的共价键类型为___________,1mol四硫富瓦烯中含有σ键数目为__________。

(2)煅烧硫铁矿时发生的反应为FeS2+O2![]() Fe2O3+SO2,所得产物SO2再经催化氧化生成SO3,SO3被水吸收生成硫酸。
Fe2O3+SO2,所得产物SO2再经催化氧化生成SO3,SO3被水吸收生成硫酸。
①基态S原子存在____________对自旋方向相反的电子。
②离子化合物FeS2中,Fe2+的电子排布式为__________,与S22-互为电子体的离子是____________。
③气体SO3分子的空间构型为__________,中心原子阶层电子对数为____________。
(3)闪锌矿是一种自然界含Zn元素的矿物,其晶体结构属于立方晶体(如下图所示),Zn属于_______区元素,在立方ZnS晶体结构中S2-的配位数为______________,若立方ZnS晶体的密度为ρg·cm-3,晶胞参数a=______nm(列出计算式),晶胞中A、B的坐标分别为A(![]() ,
, ![]() ,
, ![]() )、B(
)、B(![]() ,
, ![]() ,
, ![]() ),则C点的坐标为____________。
),则C点的坐标为____________。

【答案】 sp2 σ键和π键 15NA 7 1s22s22p63s23p63d6(或[Ar]3d6) O22- 平面三角形 3 )ds 4 ![]() (0. 0. 0.)
(0. 0. 0.)
【解析】(1)根据四硫富瓦烯分子结构可判断碳原子均形成碳碳双键,碳原子杂化轨道类型为sp2,根据电子云的重叠方式其含有的共价键类型为σ键和π键。单键均是σ键,双键中含有1个σ键和1个π键,则1mol四硫富瓦烯中含有σ键数目为15NA。(2)①基态S原子的核外电子排布为1s22s22p63s23p4,存在7对自旋方向相反的电子。②铁的原子序数是26,Fe2+的电子排布式为1s22s22p63s23p63d6(或[Ar]3d6)。原子数和价电子数分别都相等的是等电子体,则与S22-互为电子体的离子是O22-。③SO3分子中硫原子不存在孤对电子,价层电子对数是3,气体SO3分子的空间构型为平面三角形,中心原子阶层电子对数为3。(3)区的名称来自于按照构造原理最后填入电子的轨道名称,Zn属于ds区元素。在立方ZnS晶体结构中S2-的配位数为4。ZnS晶胞中的晶胞参数为anm,则晶胞的体积为(a×10-6cm)3,晶胞中含有4个ZnS,则1mol晶胞的质量为97×4g,1mol晶胞的体积为(a×10-7cm)3×6.02×1023,则ZnS晶体的密度为ρg·cm-3=(97×4g)÷[(a×10-7cm)3×6.02×1023],解得a=![]() nm。晶胞中C位于顶点处,C点的坐标为(0,0,0)。
nm。晶胞中C位于顶点处,C点的坐标为(0,0,0)。


科目:高中化学 来源: 题型:
【题目】二氧化铈(CeO2)是一种重要的稀土氧化物,平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2、FeO等物质)。某课题组以此粉末为原料,设计如下工艺流程对资源进行回收,得到纯净的CeO2和硫酸铁铵晶体。

已知:CeO2不溶于稀硫酸,也不溶于NaOH溶液。
(1)稀酸A的分子式是_____________________。
(2)滤液1中加入H2O2溶液的目的是__________________。
(3)设计实验证明滤液1中含有Fe2+_____________________。
(4)已知Fe2+溶液可以和难溶于水的FeO(OH)反应生成Fe3O4,书写该反应的离子方程式____________。
(5)由滤液2生成Ce(OH)4的离子方程式__________________。
(6)硫酸铁铵晶体[Fe2(SO4)3·2(NH4)2SO4·3H2O]广泛用于水的净化处理,但其在去除酸性废水中的悬浮物时效率降低,其原因是___________________。
(7)取上述流程中得到的Ce(OH)4产品0.531 g,加硫酸溶解后,用浓度为0.l000mol·L-1FeSO 4标准溶液滴定至终点时(铈被还原为Ce3+ ),消耗25.00 mL标准溶液。该产品中Ce(OH)4的质置分数为_______(结果保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 某有机物燃烧只生成CO2和H2O,且二者物质的量相等,则此有机物的组成为CnH2n
B. 相同质量的烃完全燃烧,消耗O2越多,烃中含H量越高
C. 一种烃在足量的氧气中燃烧并通过浓H2SO4,减少的总体积就是生成的水蒸气的体积
D. 某气态烃CxHy与足量的氧气恰好完全反应,如果反应前后气体体积不变(温度>100),则y=4;若体积减小,则y>4;否则y<4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃、101kP时,甲烷、乙烷和丙烯组成的混合烃32ml,与过量氧气混合并完全燃烧,气体经过浓硫酸干燥,恢复到原来的温度和压强,气体总体积缩小72ml,原混合烃中甲烷、乙烷、丙烯的体积比可能为( )
A. 3:2:1 B. 2:1:2 C. 4:2:5 D. 1:1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C、N、S对应的化合物,是重要的化学物质。试回答下列问题:
(1)已知:氢气的燃烧热为286.0kJ/mol,氨气的燃烧热为382.5 kJ/mol ,则合成氨反应的热化学方程式
为_____________________。
(2)利用Fe2+、Fe3+的催化作用,常温下可将SO2转化为SO42-,从而实现对SO2的治理。已知含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O,则另一反应的离子方程式为________________。
(3)用活性炭还原法处理氮氧化物。 有关反应为C(s)+2NO(g) ![]() N2(g)+CO2(g)。
N2(g)+CO2(g)。
某研究小组向密闭的真空容器中(假设容器体积不变,固体试样体积忽略不计)中加入NO和足量的活性炭,恒温(T)条件下反应,反应进行到不同时间测得各物质的浓度如表:
时间(min) 浓度(molL-1) | NO | N2 | CO2 |
0 | 1.00 | 0 | 0 |
10 | 0.58 | 0.21 | 0.21 |
20 | 0.40 | 0.30 | 0.30 |
30 | 0.40 | 0.30 | 0.30 |
40 | 0.32 | 0.34 | 0.17 |
50 | 0.32 | 0.34 | 0.17 |
①10min~20min以v(CO2)表示的反应速率为_________________。
②根据表中数据,计算T℃时该反应的平衡常数为Kp=___________,(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,保留两位小数)
③一定温度下,随着NO的起始浓度增大,则NO的平衡转化率_________(填“增大”“不变”或“减小”)。
④该反应达到平衡时下列说法正确的是______填序号字母)。
a.容器内压强保持不变 b.2v(NO)=v(N2)
c.容器内CO2的体积分数不变 d.混合气体的密度保持不变
⑤30min时改变某一条件,过一段时间反应重新达到平衡,则改变的条件可能是______。请在图中画出30~40min的变化曲线______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中互为同系物的是_____________,互为同分异构体的是_____________,互为同位素的是________________,是同一物质的是________________。
①O2和O3 ②35Cl和37Cl ③CH3CH3和CH3CH2CH3 ④氯仿和三氯甲烷
⑤CH3CH2CH(CH3)CH2CH3和CH3CH2CH(CH3)CH(CH3)CH3
⑥
⑦CH3(CH2)2CH3和(CH3)2CHCH3 ⑧CH3CH(CH3)CH3和CH(CH3)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将两种两种气态烃组成的混合气体完全燃烧,得到CO2和H2O的物质量与混合烃的物质的置的关系如图所示。
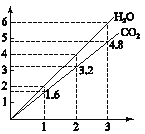
①一定有C2H4 ②一定有CH4 ③一定有C3H8 ④一定没有C2H6 ⑤可能有C2H2 ⑥可能有C3H4
则上述对该混合烃的判断正确的是
A. ②③⑤ B. ⑤⑥ C. ②④⑥ D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活息息相关,下列说法正确的是
A.医用酒精的浓度通常是95%
B.淀粉、油脂和蛋白质都是高分子化合物
C.自行车钢架生锈通常是电化学腐蚀所致
D.煤燃烧产生的烟气直接排放到空气中,易造成水体的富营养化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中错误的是
①阳离子都是由金属原子失去电子而形成的 ②非金属原子也能形成阳离子
③合金属阳离子的晶体一定是离子晶体 ④阳离子都是稳定结构,不会再失去电子
A. ①②④ B. ②③④ C. ①③④ D. ①②③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com