
【题目】C、N、S对应的化合物,是重要的化学物质。试回答下列问题:
(1)已知:氢气的燃烧热为286.0kJ/mol,氨气的燃烧热为382.5 kJ/mol ,则合成氨反应的热化学方程式
为_____________________。
(2)利用Fe2+、Fe3+的催化作用,常温下可将SO2转化为SO42-,从而实现对SO2的治理。已知含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O,则另一反应的离子方程式为________________。
(3)用活性炭还原法处理氮氧化物。 有关反应为C(s)+2NO(g) ![]() N2(g)+CO2(g)。
N2(g)+CO2(g)。
某研究小组向密闭的真空容器中(假设容器体积不变,固体试样体积忽略不计)中加入NO和足量的活性炭,恒温(T)条件下反应,反应进行到不同时间测得各物质的浓度如表:
时间(min) 浓度(molL-1) | NO | N2 | CO2 |
0 | 1.00 | 0 | 0 |
10 | 0.58 | 0.21 | 0.21 |
20 | 0.40 | 0.30 | 0.30 |
30 | 0.40 | 0.30 | 0.30 |
40 | 0.32 | 0.34 | 0.17 |
50 | 0.32 | 0.34 | 0.17 |
①10min~20min以v(CO2)表示的反应速率为_________________。
②根据表中数据,计算T℃时该反应的平衡常数为Kp=___________,(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,保留两位小数)
③一定温度下,随着NO的起始浓度增大,则NO的平衡转化率_________(填“增大”“不变”或“减小”)。
④该反应达到平衡时下列说法正确的是______填序号字母)。
a.容器内压强保持不变 b.2v(NO)=v(N2)
c.容器内CO2的体积分数不变 d.混合气体的密度保持不变
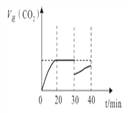
⑤30min时改变某一条件,过一段时间反应重新达到平衡,则改变的条件可能是______。请在图中画出30~40min的变化曲线______。

【答案】 N2(g)+3H2(g) ![]() 2NH3(g) ΔH1=-93.0KJ/mol 2Fe3++SO2+2H2O═2Fe2++SO42-+4H+ 0.009mol/(L·min) K=0.56 不变 acd 减小CO2的浓度 如图(作图要点:①起点和终点均比原来低,②过程趋势为增大,③终点在30min到40min之间也可在40min
2NH3(g) ΔH1=-93.0KJ/mol 2Fe3++SO2+2H2O═2Fe2++SO42-+4H+ 0.009mol/(L·min) K=0.56 不变 acd 减小CO2的浓度 如图(作图要点:①起点和终点均比原来低,②过程趋势为增大,③终点在30min到40min之间也可在40min
【解析】(1)已知:氢气的燃烧热为286.0kJ/mol,氨气的燃烧热为382.5 kJ/mol,则①1/2O2(g)+H2(g) ![]() H2O(l) ΔH1=-286.0kJ/mol,②NH3(g)+3/4O2(g)
H2O(l) ΔH1=-286.0kJ/mol,②NH3(g)+3/4O2(g) ![]() 1/2N2(g)+3/2H2O(l) ΔH2=-382.5kJ/mol,根据盖斯定律可知①×3-②×2即得到合成氨反应的热化学方程式
1/2N2(g)+3/2H2O(l) ΔH2=-382.5kJ/mol,根据盖斯定律可知①×3-②×2即得到合成氨反应的热化学方程式
为N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-93.0kJ/mol。(2)已知含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O,由于亚铁离子是催化剂,则另一反应的离子反应中铁离子又被还原为亚铁离子,方程式为2Fe3++SO2+2H2O=2Fe2++SO42-+4H+。(3)①10min~20min以v(CO2)表示的反应速率=(0.30mol/L-0.21mol/L)÷10min=0.009mol/(L·min)。②根据表中数据20min时反应达到平衡状态,T℃时该反应的平衡常数为Kp=
2NH3(g) ΔH=-93.0kJ/mol。(2)已知含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O,由于亚铁离子是催化剂,则另一反应的离子反应中铁离子又被还原为亚铁离子,方程式为2Fe3++SO2+2H2O=2Fe2++SO42-+4H+。(3)①10min~20min以v(CO2)表示的反应速率=(0.30mol/L-0.21mol/L)÷10min=0.009mol/(L·min)。②根据表中数据20min时反应达到平衡状态,T℃时该反应的平衡常数为Kp=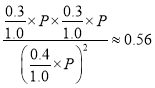 ;③反应前后体积,一定温度下,随着NO的起始浓度增大,平衡等效,则NO的平衡转化率不变。④a.反应前后体积,容器内压强保持不变,a正确;b.平衡时NO的反应速率是氮气反应速率的2倍,b错误;c.平衡时,容器内CO2的体积分数不变,c正确;d.密度是混合气的质量和容器容积的比值,在反应过程中质量是变化的,容积始终是不变的,因此混合气体的密度保持不变说明反应达到平衡状态,d正确,答案选acd;⑤30min时NO和CO2浓度均减小,氮气浓度增大,则改变的条件可能是减小CO2的浓度;根据表中数据可知30~40min的变化曲线为
;③反应前后体积,一定温度下,随着NO的起始浓度增大,平衡等效,则NO的平衡转化率不变。④a.反应前后体积,容器内压强保持不变,a正确;b.平衡时NO的反应速率是氮气反应速率的2倍,b错误;c.平衡时,容器内CO2的体积分数不变,c正确;d.密度是混合气的质量和容器容积的比值,在反应过程中质量是变化的,容积始终是不变的,因此混合气体的密度保持不变说明反应达到平衡状态,d正确,答案选acd;⑤30min时NO和CO2浓度均减小,氮气浓度增大,则改变的条件可能是减小CO2的浓度;根据表中数据可知30~40min的变化曲线为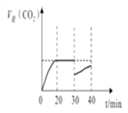 。
。


 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案科目:高中化学 来源: 题型:
【题目】金属钛性能优越,被誉为继Fe、Al后应用广泛的“第三金属”。
(1)Ti基态原子的电子排布式为____________。
(2)Ti能与B、C、N、O等非金属元素形成稳定的化合物,B、C、N的电负性由大到小的顺序为_____;C、N、O的第一电离能由大到小的顺序为_____________。
(3)N的氢化物常作制冷剂,原因是______________。
(4)月球岩石—玄武岩的主要成分为钛酸亚铁(FeTiO3)。FeTiO3与80%的硫酸反应可生成TiOSO4。
SO42-的空间构型为_______形。其中硫原子采用_________杂化,写出SO42-的一种等电子体的化学式:______。
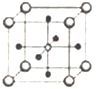
(5)Ti、Ca、O相互作用能形成如图晶体结构(Ti4+位于立方体的顶点、Ca2+位于立方体体心),该晶体的化学式为________。Ti4+和周围_____个O2-相紧邻。该晶胞的边长为apm,则其密度为______g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“海绵镍铝催化剂” 是一种多孔的镍铝合金,常用作有机催化剂。现以某粗镍(含Ni、Fe、Cu及难与酸、碱溶液反应的不溶性杂质)为原料制取该催化剂,主要流程如下:

己知:25℃时,以0.1mol/L金属离子测定得到如下数据:
物质 | CuS | Cu(OH)2 | Ni(OH)2 | NiS | Fe(OH)3 | |
Ksp | 6×10-36 | 3×10-19 | ||||
pH | 开始沉淀 | 4.7 | 7.2 | 1.9 | ||
沉淀完全 | 6.7 | 9.2 | 3.2 | |||
根据信息回答:
(1)步骤①常用热浓硫酸进行酸浸,写出酸浸时金属镍发生反应的化学方程式__________。
(2)酸浸过程应控制酸的浓度、温度等条件,如图是镍的浸出率与温度的关系,温度高于100℃时,Ni2+浸出率降低的原因可能是______________。

(3)滤液l中含有0.8mol/LNi2+、0.1mol/LFe3+、0.1mol/LCu2+,步骤②的连续操作过程需要先分离出铁元素、铜元素,再制得镍硫化合物。为达到此目的,应先加NaOH将溶液调节至_______(填pH的取值范围);再加_______(选填最佳试剂的序号)。当溶液中Ni2+开始形成NiS时,c(Cu2+)_______。(忽略溶液体积变化)
A.硝酸 B.氨水 C. A12S3 D.H2S
(4)步骤③生成的Ni(CO)4中碳的化合价与KCN中碳的化合价相同,则Ni(CO)4中Ni的化合价为______;工业上也常用NaClO氧化NiSO4,将制得的NiOOH热分解后进行还原得到Ni。ClO-在碱性条件下氧化Ni2+生成NiOOH的离子方程式为_____________。
(5)步骤⑥的目的是降低铝含量、获得多孔状的“海绵镍铝催化剂”,从而增强对氢气的吸附性,步骤⑥的离子方程式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属材料的应用推动了社会生产力的发展。下列关于金属材料的说法,正确的是( )
A.氧化镁是一种金属材料
B.合金的硬度低于它的成分金属
C.合金分为黑色金属与有色金属
D.铁合金是目前应用范围最广的合金
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定质量的甲烷燃烧后得到的产物为CO、CO2和水蒸气,此混合气体质量为49.6g,当其缓慢经过无水CaCl2时,CaCl2增重25.2g。原混合气体中CO2的质量为( )
A. 12.5g B. 24.4g C. 19.7g D. 13.2g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫及其化合物广泛存在于自然界中。
(1)四硫富瓦烯分子结构如图所示,其碳原子杂化轨道类型为_________,根据电子云的重叠方式其含有的共价键类型为___________,1mol四硫富瓦烯中含有σ键数目为__________。

(2)煅烧硫铁矿时发生的反应为FeS2+O2![]() Fe2O3+SO2,所得产物SO2再经催化氧化生成SO3,SO3被水吸收生成硫酸。
Fe2O3+SO2,所得产物SO2再经催化氧化生成SO3,SO3被水吸收生成硫酸。
①基态S原子存在____________对自旋方向相反的电子。
②离子化合物FeS2中,Fe2+的电子排布式为__________,与S22-互为电子体的离子是____________。
③气体SO3分子的空间构型为__________,中心原子阶层电子对数为____________。
(3)闪锌矿是一种自然界含Zn元素的矿物,其晶体结构属于立方晶体(如下图所示),Zn属于_______区元素,在立方ZnS晶体结构中S2-的配位数为______________,若立方ZnS晶体的密度为ρg·cm-3,晶胞参数a=______nm(列出计算式),晶胞中A、B的坐标分别为A(![]() ,
, ![]() ,
, ![]() )、B(
)、B(![]() ,
, ![]() ,
, ![]() ),则C点的坐标为____________。
),则C点的坐标为____________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有三种不同的基团,分别为―X、―Y、―Z,若同时分别取代苯环上的三个氢原子,能生成的同分异构体数目是( )
A. 4B. 6C. 8D. 10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )
A. 酸性氧化物都可以与NaOH溶液反应
B. 含金属元素的离子一定都是阳离子
C. 金属氧化物都是碱性氧化物
D. 合金一定是由两种或两种以上的金属融合而成的混合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com