
【题目】如图是模拟电化学反应装置图.下列说法正确的是( ) 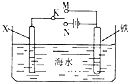
A.若X为碳棒,开关K置于N处,可以加快铁的腐蚀
B.若X为碳棒,开关K置于N处,则X极附近溶液变黄色
C.若X为锌,开关K置于M处,保护铁电极则为牺牲阳极的阴极保护法
D.若X为锌,开关K置于M处,则X电极的反应式为:O2+4e+2H2O→4OH﹣
科目:高中化学 来源: 题型:
【题目】设NA代表阿伏加德罗常数的值,下列说法正确的是( )
A. 标准状况下,22.4L氦气所含质子数为4NA
B. 3mol Fe在氧气中完全燃烧失去的电子数为9NA
C. 32gO2与足量的钠完全反应转移的电子数不一定为4NA
D. 1mol/L的H2SO4溶液中所含H+数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学按如图所示的装置进行试验.A,B两种常见金属,它们的硫酸盐可溶于水,当K闭合时,在交换膜处SO ![]() 从右向左移动.下列说法错误的是( )
从右向左移动.下列说法错误的是( ) 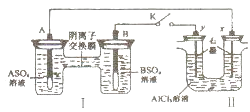
A.电解一段时间后,向Ⅱ装置通入适量的HCl气体可以恢复原来的浓度
B.反应初期,y电极周围出现白色沉淀
C.B电极质量增加
D.x电极产生气泡,且生成1mol气体的同时,有1molA参与反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯碱工业是以电解饱和食盐水为原理的重要化工生产业.
(1)电解饱和食盐水的化学方程式是
(2)电解时阳极区溶液的pH用盐酸控制在2~3,用化学平衡移动原理解释盐酸的作用;
(3)用于电解的食盐水需先除去其中的Ca2+、Mg2+、SO42﹣等杂质.某次除杂操作时,往粗盐水中先加入过量的(填化学式),至沉淀不再产生后,再加入过量的(填化学式)和NaOH,充分反应后将沉淀一并滤去.经检测发现滤液中仍含有一定量的SO42﹣ , 解释其原因[已知:Ksp(BaSO4)=1.1×10﹣10、Ksp(BaCO3)=5.1×10﹣9].
(4)食盐水中若含有NH4+ , 会在阳极产生难溶于水的NCl3 , 写出该电极反应式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由下列实验及现象不能推出相应结论的是( )
实验 | 现象 | 结论 | |
A. | 向2 mL 0.1 | 黄色逐渐消失,加KSCN溶液颜色不变 | 还原性: |
B. | 将金属钠在燃烧匙中点燃,迅速伸入集满CO2的集气瓶 | 集气瓶中产生大量白烟,瓶内有黑色颗粒产生 | CO2具有氧化性 |
C. | 加热盛有少量NH4HCO3固体的试管,并在试管口放置湿润的红色石蕊试纸 | 石蕊试纸变蓝 | NH4HCO3受热易分解,生成了遇水显碱性的物质 |
D. | 向某溶液中加入盐酸,将生成的气体通入品红溶液中 | 品红溶液褪色 | 该溶液一定含有SO32- |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向59.2g Fe2O3和FeO的混合物中加入某浓度的稀硝酸1.0L,固体物质完全反应,生成NO和Fe(NO3)3。在所得溶液中加入1.0mol/L的NaOH溶液2.8L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为85.6g。下列有关说法错误的是 ( )
A. Fe2O3和FeO的物质的量之比为1:6
B. 硝酸的物质的量浓度为3.0mol/L
C. 产生的NO在标准状况下的体积为4.48L
D. Fe2O3和FeO与硝酸反应后剩余0.2molHNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知N2(g)+3H2(g)2NH3(g)+Q1反应历程的能量变化如曲线I,说法正确的是( ) 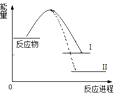
A.1molN≡N键能与3molH﹣H键能之和大于6molN﹣H键能,所以反应为放热
B.N2(g)+3H2(g)2NH3(l)+Q2反应历程的能量变化如曲线Ⅱ,则Q2>Q1
C.选择合适的催化剂,可以降低反应所需温度,Q1值也相应减少
D.2mol氨气的能量高于1mol氮气和3mol氢气的能量之和,所以反应需要高温
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:4NH3+5O2=4NO+6H2O,若反应速率分别用ν(NH3)、ν(O2)、ν(NO)、ν(H2O)(摩/升分)表示,则正确的关系是( )
A.![]() ν(NH3)=ν(O2)
ν(NH3)=ν(O2)
B.![]() ν(O2)=ν(H2O)
ν(O2)=ν(H2O)
C.![]() ν(NH3)=ν(H2O)
ν(NH3)=ν(H2O)
D.![]() ν(O2)=ν(NO)
ν(O2)=ν(NO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向59.2g Fe2O3和FeO的混合物中加入某浓度的稀硝酸1.0L,固体物质完全反应,生成NO和Fe(NO3)3。在所得溶液中加入1.0mol/L的NaOH溶液2.8L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为85.6g。下列有关说法错误的是 ( )
A. Fe2O3和FeO的物质的量之比为1:6
B. 硝酸的物质的量浓度为3.0mol/L
C. 产生的NO在标准状况下的体积为4.48L
D. Fe2O3和FeO与硝酸反应后剩余0.2molHNO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com