
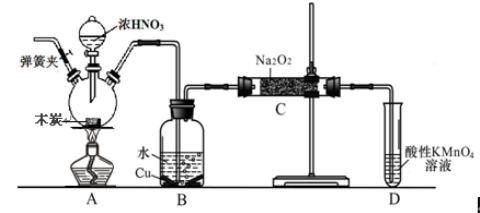
【题目】亚硝酸钠被称为工业盐,不能用作食品工业,但在漂白、电镀等方面应用广泛。现以木炭、浓硝酸、水和铜为原料生成的一氧化氮与过氧化钠反应制备亚硝酸钠的装置如下图所示(部分夹持装置略)。
已知:室温下,①2NO+Na2O2 = 2NaNO2
②3NaNO2+3HCl == 3NaCl+HNO3+2NO↑+H2O;
③酸性条件下,NO或NO2– 都能与MnO4–反应生成NO3– 和Mn2+
完成下列填空:
(1)写出浓硝酸与木炭反应的化学方程式 。
(2) B中观察到的主要现象是有无色气体产生和 ,D装置的作用是 。
(3)检验C中产物有亚硝酸钠的方法是 。
(4)经检验C产物中除亚硝酸钠外还含有副产物碳酸钠和氢氧化钠,为避免产生这些副产物应在B、C装置间增加装置,则该装置中盛放的药品名称 。
(5)将7.8g过氧化钠完全转化成为亚硝酸钠,理论上至少需要木炭 g。
【答案】(1)C+4HNO3(浓) ![]() CO2↑+4NO2↑+2H2O
CO2↑+4NO2↑+2H2O
(2)铜片逐渐溶解,溶液变为蓝色 吸收未反应的NO
(3)取样,加入稀盐酸,产生无色气体,遇到空气变为红棕色
(4)碱石灰 (5)1.8g
【解析】
试题分析:(1)浓硝酸与木炭反应的化学方程式C+4HNO3(浓) ![]() CO2↑+4NO2↑+2H2O。
CO2↑+4NO2↑+2H2O。
(2) A中生成的NO2进入B中与水反应生成硝酸,B中铜与稀硝酸反应生成NO和硝酸铜,观察到的主要现象是有无色气体产生和铜片逐渐溶解,溶液变为蓝色,酸性条件下,NO或NO2– 都能与MnO4–反应生成NO3– 和Mn2+,D装置的作用是吸收未反应的NO。
(3)根据3NaNO2+3HCl == 3NaCl+HNO3+2NO↑+H2O,检验C中产物有亚硝酸钠的方法是取样,加入稀盐酸,产生无色气体,遇到空气变为红棕色。
(4)副产物碳酸钠和氢氧化钠是过氧化钠与二氧化碳、水反应生成的,为避免产生这些副产物应在B、C装置间增加装置,除去二氧化碳、水,则该装置中盛放的药品名称碱石灰。
(5)![]() ,将7.8g过氧化钠完全转化成为亚硝酸钠,理论上至少需要木炭1.8g。
,将7.8g过氧化钠完全转化成为亚硝酸钠,理论上至少需要木炭1.8g。


科目:高中化学 来源: 题型:
【题目】工业上生产高氯酸时,还同时生产了一种常见的重要含氯消毒剂和漂白剂亚氯酸钠(NaClO2),其工艺流程如下:

已知:①NaHSO4溶解度随温度的升高而增大,适当条件下可结晶析出。
②高氯酸是至今为止人们已知酸中的最强酸,沸点90 ℃。
请回答下列问题:
(1)反应器Ⅰ中发生反应的化学方程式为 ,冷却的目的是 ,能用蒸馏法分离出高氯酸的原因是___________________。
(2)反应器Ⅱ中发生反应的离子方程式为__________________________。
(3)通入反应器Ⅱ中的SO2用H2O2代替同样能生成NaClO2,请简要说明双氧水在反应中能代替SO2的原因是___________________。
(4) Ca(ClO)2、ClO2、NaClO2等含氯化合物都是常用的消毒剂和漂白剂,是因为它们都具有__________,请写出工业上用氯气和消石灰生产漂粉精的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】东晋《华阳国志南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)文明中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)镍元素基态原子的电子排布式为_________,3d能级上的未成对的电子数为______。
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是_____。
②在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为______ ,提供孤电子对的成键原子是_____。
③氨的沸点_____(“高于”或“低于”)膦(PH3),原因是______;氨是_____分子(填“极性”或“非极性”),中心原子的轨道杂化类型为_______。
(3)单质铜及镍都是由______键形成的晶体:元素铜与镍的第二电离能分别为:ICu=1958kJ/mol,INi=1753kJ/mol,ICu>INi的原因是______。
(4)某镍白铜合金的立方晶胞结构如图所示。
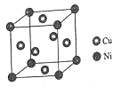
①晶胞中铜原子与镍原子的数量比为_____。
②若合金的密度为dg/cm3,晶胞参数a=________nm
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质发生化学反应时:①电子总数;②质子总数;③物质的结构;④分子总数;⑤物质所具有的总能量;⑥物质的总质量。反应前后肯定发生变化的是( )
A.①② B.⑤⑥ C.④⑥ D.③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]
卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们。
(1)卤族元素位于周期表的_________区;溴的价电子排布式为_________ __________。
(2)在不太稀的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的。使氢氟酸分子缔合的作用力是________________。
(3)请根据下表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是_ _
氟 | 氯 | 溴 | 碘 | 铍 | |
第一电离能 (kJ/mol) | 1681 | 1251 | 1140 | 1008 | 900 |
(4)碘在水中的溶解度虽然小,但在碘化钾溶液中溶解度却明显增大这是由于溶液中发生下列反应I-+I2=I3-。I3-离子的中心原子周围σ键电子对对数为___ __,孤电子对对数为__ ____
与KI3类似的,还有CsICl2等。已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列___ __式发生。
A.CsICl2=CsCl+ICl
B.CsICl2=CsI+Cl2
(5)已知ClO2-为V形,中心氯原子周围有四对价层电子。ClO2-中心氯原子的杂化轨道类型为___________,写出一个ClO2-的等电子体__________。
(6)如图为碘晶体晶胞结构。有关说法中正确的是__________。

A.碘分子的排列有2种不同的取向,2种取向不同
的碘分子以配位数4交替配位形成层结构
B.用均摊法可知平均每个晶胞中有4个碘原子
C.碘晶体为无限延伸的空间结构,是原子晶体
D.碘晶体中的碘原子间存在非极性键和范德华力
(7)已知CaF2晶体(见图)的密度为ρg/cm3,NA为阿伏加德罗常数,相邻的两个Ca2+的核间距为a cm,则CaF2的相对分子质量可以表示为__________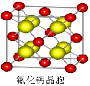 _。
_。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的描述和相关知识均正确的是( )
物质及变化 | 描述 | 相关知识 | |
A | 碘化钾溶液滴到土豆片上 | 变蓝色 | 土豆片含淀粉 |
B | 煤的气化 | 化学变化 | 主要反应是碳与水生成水煤气等 |
C | 乙烯和苯 | 都能使溴水褪色 | 分子中含有相同的碳碳双键 |
D | 蔗糖和麦芽糖 | 多糖 | 二者互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)是一种高效消毒剂,沸点为11℃。用KClO3粉末与草酸(H2C2O4)在60℃时反应可生成ClO2等物质,实验装置如下图所示:
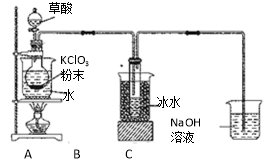
⑴ 装置A中还应安装的玻璃仪器是 ,装置B用冰水浴的原因是 。
⑵ 装置A中反应产物有K2CO3、ClO2和CO2等,请写出该反应的化学方程式: 。
⑶ ①实验过程中,装置C中少量的ClO2与NaOH溶液反应产生两种钠盐,且物质的量之比为1:1,其中一种为NaClO2,写出装置C中生成这两种钠盐的离子方程式: 。
②饱和溶液在温度低于38℃时析出晶体NaClO2·3H2O,在温度高于38℃时析出晶体NaClO2。请补充从NaClO2溶液中制得NaClO2晶体的操作步骤:a.____________;b_____________;c.洗涤;d.干燥。
⑷ 还可采用盐酸或双氧水还原氯酸钠制备ClO2。用H2O2作还原剂制备ClO2更受欢迎,其主要原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:苯和卤代烃在催化剂的作用下可以生成烷基苯和卤化氢,A是水果的催熟剂,C是生活中常见的有机物,乙苯能被酸性高锰酸钾溶液氧化为苯甲酸。几种物质之间的转化关系如图所示(生成物中所有无机物均已略去)。
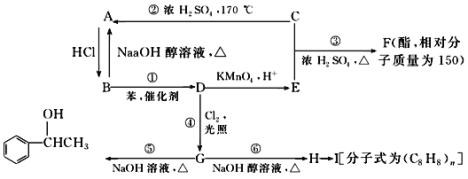
请回答下列问题:
⑴写出物质的结构简式:写出物质的结构简式:A____________,F_________,E__________。
⑵在①~⑥6个反应中,属于消去反应的是________(填编号)。
⑶写出下列反应的化学方程式:
①_____________________________;
②_____________________________;
⑥_____________________________。
H→I___________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com