
����Ŀ��[��ѧ����ѡ��3�����ʽṹ������]
±��Ԫ�صĵ��ʺͻ�����ܶ࣬���ǿ���������ѧ���ʽṹ�����ʵ����֪ʶȥ��ʶ���������ǡ�
��1��±��Ԫ��λ�����ڱ���_________������ļ۵����Ų�ʽΪ_________ __________��
��2���ڲ�̫ϡ����Һ�У���������Զ����ӵ���HF��2��ʽ���ڵġ�ʹ�������ӵϵ���������________________��
��3��������±��ṩ�ĵ�һ�����������жϣ����п������ɽ��ȶ��ĵ��������ӵ�±��ԭ����_ _
�� | �� | �� | �� | �� | |
��һ������ ��kJ/mol�� | 1681 | 1251 | 1140 | 1008 | 900 |
��4������ˮ�е��ܽ����ȻС�����ڵ⻯����Һ���ܽ��ȴ������������������Һ�з������з�ӦI-+I2=I3-��I3-���ӵ�����ԭ����Χ�Ҽ����ӶԶ���Ϊ___ __���µ��ӶԶ���Ϊ__ ____
��KI3���Ƶģ�����CsICl2������֪CsICl2���ȶ��������ֽ⣬���������ɾ����ܸ�������ʣ�����������___ __ʽ������
A��CsICl2=CsCl+ICl
B��CsICl2=CsI+Cl2
��5����֪ClO2-ΪV�Σ�������ԭ����Χ���ĶԼ۲���ӡ�ClO2-������ԭ�ӵ��ӻ��������Ϊ___________��д��һ��ClO2-�ĵȵ�����__________��
��6����ͼΪ�⾧�徧���ṹ���й�˵������ȷ����__________��

A������ӵ�������2�ֲ�ͬ��ȡ����2��ȡ��ͬ
�ĵ��������λ��4������λ�γɲ�ṹ
B���þ�̯����֪ƽ��ÿ����������4����ԭ��
C���⾧��Ϊ��������Ŀռ�ṹ����ԭ�Ӿ���
D���⾧���еĵ�ԭ�Ӽ���ڷǼ��Լ��ͷ��»���
��7����֪CaF2��������ͼ�����ܶ�Ϊ��g/cm3��NAΪ�����ӵ����������ڵ�����Ca2+�ĺ˼��Ϊa cm����CaF2����Է����������Ա�ʾΪ__________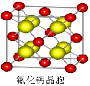 _��
_��
���𰸡���1��p��4s24p5 ��2����� ��3���� ��4��2��3��A
��5��sp3�ӻ���Cl2O��OF2��BrO2-�� ��6��AD ��7��a3��NA/4
��������
�����������1��±��Ԫ��λ�����ڱ���17����P��������������Ԫ����ԭ�ӵļ۵����Ų�Ϊ4S24P5;
��2���������Ӽ�ͨ������ϳ���HF��2��
��3�����ڵ�ĵ�һ��������±��ԭ������Խ�С�����п������ɽ��ȶ��ĵ��������ӡ�
��4��I3-���ӵ�����ԭ����Χ�Ҽ����ӶԶ���Ϊ2���µ��ӶԶ���Ϊ3��CsCl�ľ����ܴ���CsI����CsICl2=CsCl+ICl������
��5������ClO2- ��������ԭ����Χ���ĶԼ۲���ӣ���������ԭ�ӵ��ӻ��������Ϊsp3;���ݡ��������ڡ�ͬ�廥������ԭ���ȷ��ClO2- �ĵȵ�����ΪCl2O��BrO2-��OF2��
��6���⾧�徧���ṹ������������������ÿ�������к���8��![]() +6��
+6��![]() =4������ӣ�����ԭ����Ϊ8��B�����;�⾧�����ڷ��Ӿ��壬C�����
=4������ӣ�����ԭ����Ϊ8��B�����;�⾧�����ڷ��Ӿ��壬C�����
��7����CaF2�������Ca2+:8��![]() +6��
+6��![]() =4��������F-:8�����൱����4��CaF2�����=
=4��������F-:8�����൱����4��CaF2�����=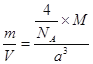 �������M=a3��NA/4��
�������M=a3��NA/4��


 ���Ŀ��ּ�����ҵ�����ҵ����������ϵ�д�
���Ŀ��ּ�����ҵ�����ҵ����������ϵ�д� ����ѵ��ϵ�д�
����ѵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�����Һ�п��ܺ���H2SO4��MgCl2��Al2(SO4)3��NH4Cl��NaCl�еļ������ʣ�������Һ������NaOH��Һ���������������ʵ���(n)������NaOH��Һ���(V)�Ĺ�ϵ��ͼ��ʾ���ش��������⣺
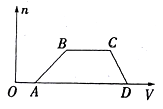
��1����Һ��һ�����е�������__________(�ѧʽ)��
��2����Һ��һ�������е�������__________(�ѧʽ)��
��3����Һ�п��ܺ��е�������__________(�ѧʽ)������ɫ��Ӧ�����ж��Ƿ��и����ʣ�������_________________��
��4���ֱ�д��AB�Ρ�CD�η��������ӷ���ʽ���� AB��Ϊ_________________����CD��Ϊ________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ�ǵģ� ��
A��CH2(OH)CH2OH���Ҵ���ͬϵ��
B�����������춡�黥Ϊͬ���칹�������ʯ��ʯīҲ��
C����ϩ��ˮ�ӳ���2��ͬ���칹�����
D��SiO2�ȿ��Ժ�NaOH��Һ��Ӧ���ֿ���������ᷴӦ��������Ϊ����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ݷ�Ӧ��2H2S��O2=2S����2H2O��Na2S��I2=2NaI��S��
4NaI��O2��2H2SO4=2I2��2Na2SO4��2H2O���������ʵ�������ǿ���ж���ȷ����
A��H2O>NaI>H2S B��H2S>NaI>H2O C��S>I2>O2 D��O2>I2>S
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ױ���һ����Ҫ�Ĺ�ҵԭ�ϣ�ij��ѧѧϰС�������ͼ��ʾװ���Ʊ�һ�����ױ��������������ױ����������ױ���
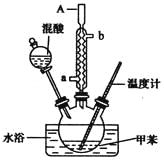
ʵ�鲽�����£�
������Ũ�����Ũ����Ļ������ᣩ��
����������ƿ��װ15 mL�ױ����ܶ�Ϊ0.866 g��cm��3����
��װ������ҩƷ������װ��������
����������ƿ�м�����ᣬ�����Ͻ��裻
�������¶ȣ���Լ��Ӧ10������������ƿ���д���Һ�壨����ɫ��״�����֣�
�������һ�����ױ������ᴿ���յõ�һ�����ױ���15 g��
��������ʵ�飬�ش��������⣺
��1����ʵ��Ĺؼ��ǿ����¶���30�����ң�����¶ȹ��ߣ�������__________�ȸ���Ʒ�����������ƣ�
��2���������ƻ���ķ�����____________________��
��3��A����������__________����ˮ����__________��
��4��д���ױ�����ᷴӦ���ɶ������ױ��Ļ�ѧ����ʽ��___________________________��
��5�������Ʒ�������£�
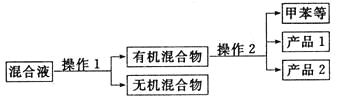
����2��������___________�����ⶨ����Ʒ2�ĺ˴Ź�����������5���壬��������Ϊ___________��
��6����ʵ����һ�����ױ��IJ���Ϊ___________ �����������λ��Ч���֣�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������Ʊ���Ϊ��ҵ�Σ���������ʳƷ��ҵ������Ư�ס���Ƶȷ���Ӧ�ù㷺������ľ̿��Ũ���ᡢˮ��ͭΪԭ�����ɵ�һ��������������Ʒ�Ӧ�Ʊ��������Ƶ�װ������ͼ��ʾ�����ּг�װ��������
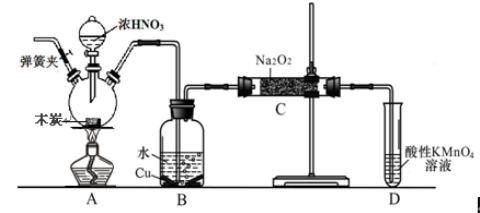
��֪�������£���2NO+Na2O2 �� 2NaNO2
��3NaNO2+3HCl == 3NaCl+HNO3+2NO��+H2O��
�����������£�NO��NO2�C ������MnO4�C��Ӧ����NO3�C ��Mn2+
���������գ�
��1��д��Ũ������ľ̿��Ӧ�Ļ�ѧ����ʽ ��
��2�� B�й۲쵽����Ҫ����������ɫ��������� ��Dװ�õ������� ��
��3������C�в������������Ƶķ����� ��
��4��������C�����г�������������и�����̼���ƺ��������ƣ�Ϊ���������Щ������Ӧ��B��Cװ�ü�����װ�ã����װ����ʢ�ŵ�ҩƷ���� ��
��5����7.8g����������ȫת����Ϊ�������ƣ�������������Ҫľ̿ g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���� ��������
A��������ʯ�͡�ú����֬�����ڻ�ʯȼ��
B�����Ǽ���ˮ�������ɷ���������Ӧ
C������ʽΪ��C6H10O5��n�ĵ��ۺ���ά�ػ�Ϊͬ���칹��
D����֬�ڼ��������µ�ˮ�ⷴӦ�ֳ�Ϊ������Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����15g CH4��C2H4�Ļ������ͨ��ʢ��������ˮ�������У���ˮ������������7g������������CH4��C2H4�������Ϊ�� ��
A.1��2 B.2��1 C.3��2 D.2��3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�Ksp(CaSO4)=9��10-6�������£�CaSO4��ˮ�еij����ܽ�ƽ��������ͼ��ʾ�������жϴ������
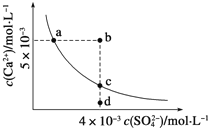
A. a��c��������Ա�ʾ������CaSO4����ˮ���γɵı�����Һ
B. a���Ӧ��Ksp����c���Ӧ��Ksp
C. b�㽫�г������ɣ�ƽ�����Һ��c(SO42-)һ��������3��10-3molL-1
D. ��d����Һ�м�������CaCl2������Ա䵽c��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com