
【题目】如图为原电池装置示意图:
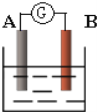
(1)若A为Zn,B为石墨棒,电解质溶液为稀硫酸,则A为________极(填正或负),写出电极反应式:正极_______________________,负极________________________.总反应为:____________________。
(2)若A为铜片,B为铁片,电解质为FeCl3溶液,则A为________极(填正或负),写出电极反应式:正极_____________________________,负极________________________.总反应为:_______________________________。
(3)若A、B均为铂片,电解质为KOH溶液,分别从A、B两极通入H2和O2,该电池即为燃料电池,通入氧气的一极为该电池的________极(填正或负),该电池的总反应为:____________________
【答案】负 2H++2e-=H2↑ Zn-2e-=Zn2+ Zn+2H+=Zn2++H2↑ 正 Fe3++e-=Fe2+ Fe-2e-=Fe2+ 2Fe3++Fe=3Fe2+ 正 2H2+O2=2H2O
【解析】
(1)该原电池中,锌失电子变成离子进入溶液,所以锌极即A极为负极;石墨为正极,正极上氢离子得电子生成氢气,所以电极反应式为:2H++2e-=H2↑;负极电极反应式为:Zn-2e-=Zn2+;总反应为:Zn+2H+=Zn2++H2↑;
(2)该原电池中,铁片失电子变成二价铁离子进入溶液,B电极为负极,电极反应式为:Fe-2e-=Fe2+;铜片作正极,正极上三价铁离子得电子生成二价铁离子,电极反应式为:Fe3++e-=Fe2+;总反应为:2Fe3++Fe=3Fe2+;
(3)在原电池中失电子的一极为负极,得电子的一极为正极,在氢氧燃料电池中,氧气得电子,所以通入氧气的一极为该电池的正极;氢气和氧气反应生成水,所以电池反应式为:2H2+O2=2H2O。


科目:高中化学 来源: 题型:
【题目】常温下有浓度均为0.5 mol![]() 的四种溶液:
的四种溶液:
①Na2CO3;②NaHCO3;③HCl;④NH3![]() H2O。
H2O。
(1)上述溶液中,可发生水解的是_____(填序号)。
(2)上述溶液中,既能与氢氧化钠反应,又能和硫酸反应的溶液中离子浓度由大到小的顺序为_______。
(3)向溶液④中加入少量氯化铵固体,此时![]() 的值_____(填“增大”“减小”或“不变”),c(OH-)变____(填“变大”“变小”或“不变”)
的值_____(填“增大”“减小”或“不变”),c(OH-)变____(填“变大”“变小”或“不变”)
(4)若将③和④混合后溶液恰好呈中性,则混合前③的体积____④的体积(填“大于”“小于”或“等于”),此时溶液中离子浓度由大到小的顺序是___。
(5)取10 mL溶液③,加水稀释到500 mL,则该溶液中由水电离出的c(H+)=___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用NaBr、浓H2SO4、乙醇为原料制备少量溴乙烷:
C2H5—OH+HBr![]() C2H5Br+H2O
C2H5Br+H2O
已知反应物的用量为:0.30 mol NaBr(s);0.25 mol C2H5OH(密度为0.80 g·cm-3);36 mL浓H2SO4(质量分数为98%,密度为1.84 g·mL-1);25 mL水。试回答下列问题。
(1)该实验应选择图中的a装置还是b装置?_____________。
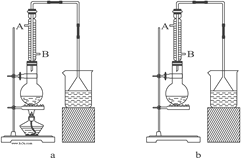
(2)反应装置中的烧瓶应选择下列哪种规格最合适(_____)
A.50 mL B.100 mL C.150 mL D.250 mL
(3)冷凝管中的冷凝水的流向应是(_____)
A. A进B出 B. B进A出 C. 从A进或B进均可
(4)可能发生的副反应为:_____________、__________、______________(至少写出3个方程式)。
(5)实验完成后,须将烧瓶内的有机物蒸出,结果得到棕黄色的粗溴乙烷,欲得纯净溴乙烷,应采用的措施是_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在 2L 密闭容器中,3mol A 和 1molB 发生反应:3A(g)+B(g)2C(g)+2D(g),10s 末时,生成 1.2mol C,下列说法正确的是
A.10s 内,v(D)=0.12 mol/(L·s)B.10s 末时,物质 A 的转化率为 60%
C.10s 末时,B的浓度为0.3mol/LD.10s 末时,C 的物质的量分数为 15%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下合成乙烯: 6 H2(g) +2CO2(g)![]() CH2=CH2(g) +4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法正确的是
CH2=CH2(g) +4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法正确的是
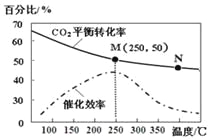
A. 生成乙烯的速率:v(M)一定小于v(N)
B. 化学平衡常数:KN>K M
C. 当温度高于250℃时,升高温度,平衡向逆反应方向移动,从而使催化剂的催化效率降低
D. 若投料比n(H2):n(CO2)=3:1,则图中M点时,乙烯的体积分数为7.7%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】鲜花保鲜剂S-诱抗素制剂,可保证鲜花盛开。S-诱抗素的分子结构如下图,下列关于该物质的说法不正确的是( )
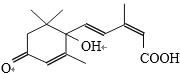
A. 其分子式为C15H20O4
B. 1mol该物质完全燃烧,需要消耗20mol氧气
C. 既能发生加成反应,又能发生取代反应
D. 既能使紫色石蕊试剂显红色,又能使酸性KMnO4溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用。钛酸钡晶体的晶胞结构示意图如图所示,它的化学式是
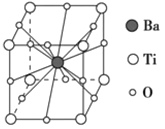
A. BaTi8O12
B. BaTiO3
C. BaTi2O4
D. BaTi4O6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】200℃、101kPa时,在密闭容器中充入1molH2和1molI2,发生反应I2(g)+H2(g)![]() 2HI(g) ΔH=-14.9 kJ/mol。反应一段时间后,能说明反应已经达到化学平衡状态的是
2HI(g) ΔH=-14.9 kJ/mol。反应一段时间后,能说明反应已经达到化学平衡状态的是
A. 放出的热量小于14.9 kJ
B. 反应容器内压强不再变化
C. HI生成的速率与HI分解的速率相等
D. 单位时间内消耗a mol H2,同时生成2a mol HI
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是应用最广泛的金属,铁的卤化物,氧化物以及高价铁的含氧酸盐均为重要化合物。
(1)铁元素在周期表中的位置为_______。
(2)要确定铁的某氯化物FeClx的化学式,可利用离子交换和滴定的方法。实验中称取0.54 g的FeClx样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH-的阴离子交换柱,使Cl-和OH-发生交换。交换完成后,流出溶液的OH-用0.40 mol·L-1的盐酸滴定,滴至终点时消耗盐酸25.0 mL。则x=_____。
(3)实验室用铁氰化钾确定某铁的氯化物中是否含有FeCl2,该反应的离子方程式为_____。
(4)Fe(OH)3固体与氢碘酸反应时可生成棕色物质的离子方程式为________。
(5)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3和KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为_______。
(6)实验室准确称取1.44g草酸亚铁固体,在空气中灼烧,得到0.773g铁的氧化物,写出该铁的氧化物的化学式__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com