
分析 X、Y、Z三种气体,都能造成大气污染,X、Y、Z可以用碱溶液吸收,说明这三种气体是酸性氧化物或与水反应生成酸;
X是化石燃料燃烧的产物之一,是形成酸雨的主要物质,则X是SO2;
Y是一种单质,它的水溶液具有漂白性,则Y是Cl2;
Z是硝酸工业和汽车尾气中的有害成分之一,能和水反应,则Z是NO2;
再结合物质性质分析解答.
解答 解:X、Y、Z三种气体,都能造成大气污染,X、Y、Z可以用碱溶液吸收,说明这三种气体是酸性氧化物或与水反应生成酸;
X是化石燃料燃烧的产物之一,是形成酸雨的主要物质,则X是SO2;
Y是一种单质,它的水溶液具有漂白性,则Y是Cl2;
Z是硝酸工业和汽车尾气中的有害成分之一,能和水反应,则Z是NO2;
(1)X是SO2,Y为Cl2,Z为NO2,
故答案为:SO2; Cl2; NO2;
(2)①X是SO2,与NaOH溶液反应生成亚硫酸钠和水货亚硫酸氢钠,反应的化学方程式为:SO2+2NaOH═Na2SO3+H2O 或SO2+NaOH═NaHSO3,
故答案为:SO2+2NaOH═Na2SO3+H2O 或SO2+NaOH═NaHSO3;
②Z与水的反应是二氧化氮和水反应生成硝酸和一氧化氮,反应的化学方程式为:3NO2+H2O═2HNO3+NO,故答案为:3NO2+H2O═2HNO3+NO.
点评 本题考查无机物推断,明确气体的性质、反应现象是推断物质关键,熟练掌握元素化合物知识,知道次氯酸漂白性原理和二氧化硫形成酸雨为突破点,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | H2O与D2O互称同位素 | B. | 氘(D)原子核外有1个电子 | ||
| C. | H与 D中子数不同 | D. | H218O与D216O的相对分子质量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 对于有气体参加的反应,增大压强,反应速率加快,是因为活化分子百分数增加 | |
| B. | 设NA为阿伏加德罗常数的值,500 mL 1mol/L氯化铁溶液中Fe3+的数目等于0.5NA | |
| C. | 常温下将干燥的pH试纸浸泡在0.01mol/L的NaOH溶液中来测溶液的pH,测得pH=12 | |
| D. | 要判断反应进行方向,须综合考虑体系的焓变和熵变,焓减且熵增的反应为自发反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
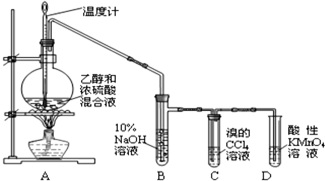
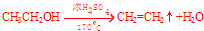 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 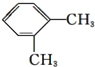 | B. |  | C. |  | D. | 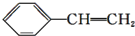 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
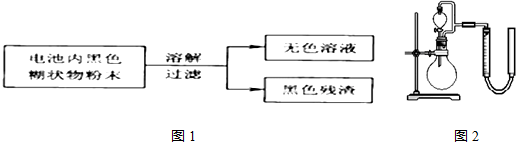
| 实验步骤 | 实验现象 | 实验结论和解释 |
| 取少量上述无色溶液于试 管中,逐滴加入NaOH溶液,直至过量,再加热 | 生成白色沉淀,白色沉淀逐渐溶解,产生刺激性气味的气体 | 无色溶液中存在Zn2+、NH4+离子 检验NH4+离子存在的离子方程式是将溶液加热,并将湿润的红色石蕊试纸贴在玻璃棒的一端置于试管口;红色石蕊试纸变蓝 |
| 序号 | 烧瓶中的物质 | 实验记录 | 实验结论与解释 |
| 实验一 | 足量MnO2 | 收集到56mL气体 | MnO2做催化剂 |
| 实验二 | 足量MnO2和稀硫酸 | 黑色粉末部分溶解, 收集到112mL气体 | MnO2做氧化剂,生成Mn2+离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在铁件上镀铜时,金属铜作阳极 | |
| B. | 实验室制氢气用粗锌比用纯锌速率快 | |
| C. | 电解精炼铜时,粗铜电极上每转移0.2 mol e-,阴极析出6.4 g Cu(忽略能量损失) | |
| D. | 甲醇和氧气以及KOH溶液构成的新型燃料电池中,负极反应为:CH3OH+6OH--6e-═CO2+5H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com