
| A. | 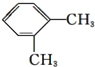 | B. |  | C. |  | D. | 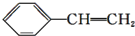 |
分析 某烃的分子式为C8H10,它不能使溴水褪色,能使酸性高锰酸钾溶液褪色,含有苯环,结合C、H原子数目关系可知,属于苯的同系物,该有机物苯环上的一氯代物只有1种,苯环上有1种H原子,据此确定.
解答 解:某烃的分子式为C8H10,它不能使溴水褪色,能使酸性高锰酸钾溶液褪色,含有苯环,结合C、H原子数目关系可知,属于苯的同系物,该有机物苯环上的一氯代物只有1种,苯环上有1种H原子,
A.邻二甲苯苯环上有3种H原子,故A错误;
B.对二甲苯苯环上有1种H原子,故B正确;
C.乙苯苯环上有3种H原子,故C错误;
D.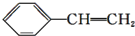 不是苯的同系物,故D错误.
不是苯的同系物,故D错误.
故选B.
点评 本题考查了同分异构体的书写、有机物结构的确定,难度中等,侧重考查学生思考问题的全面性.


科目:高中化学 来源: 题型:选择题
| A. | 在相同温度下的溶解度:Na2CO3>NaHCO3 | |
| B. | 热稳定性:Na2CO3>NaHCO3>H2CO3 | |
| C. | 表示Na2CO3和NaHCO3分别与Ba(OH)2溶液反应的离子方程式相同 | |
| D. | 等质量的Na2CO3和NaHCO3分别与等浓度的HCl溶液完全反应,后者消耗的盐酸少 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯水的颜色呈浅绿色,说明氯水中含有Cl2 | |
| B. | 向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl- | |
| C. | 向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+ | |
| D. | 向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 玻璃是人类是早使用的硅酸盐材料 | |
| B. | 玻璃在加热熔化时有固定的熔点 | |
| C. | 制普通玻璃的主要原料是纯碱、石灰石、石英 | |
| D. | 普通水泥的成分主要是硅酸钠、硅酸钙和二氧化硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④⑤① | B. | ②③①④⑤ | C. | ①②③④⑤ | D. | ②①③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
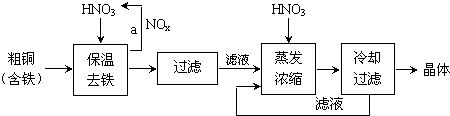
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ Cu2+ | 1.9 4.7 | 3.2 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
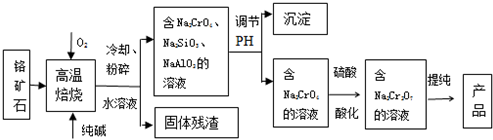
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
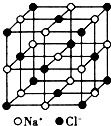 氟是非金属性最强的元素.
氟是非金属性最强的元素.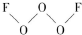 ,其中氧原子采用的轨道杂化方式是sp3,又如O2F2是一种强氧化剂,运用VSEPR模型判断O2F2是极性(填“极性”或“非极性”)分子.
,其中氧原子采用的轨道杂化方式是sp3,又如O2F2是一种强氧化剂,运用VSEPR模型判断O2F2是极性(填“极性”或“非极性”)分子.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com