
| A. | 玻璃是人类是早使用的硅酸盐材料 | |
| B. | 玻璃在加热熔化时有固定的熔点 | |
| C. | 制普通玻璃的主要原料是纯碱、石灰石、石英 | |
| D. | 普通水泥的成分主要是硅酸钠、硅酸钙和二氧化硅 |
分析 A.人类最早使用的硅酸盐材料是陶瓷;
B.晶体有固定熔点,非晶体没有熔点,玻璃是硅酸盐,没有固定的熔点;
C.用石灰石、石英和纯碱来制普通玻璃;
D.制造水泥的主要原料是石灰石和黏土在高温条件下,在水泥回转窑中发生反应,生成硅酸盐:3CaO•SiO2、2CaO•SiO2、3CaO•Al2O3.
解答 解:A.陶瓷是人类最早使用的硅酸盐材料,故A错误;
B.玻璃是硅酸盐,因玻璃是玻璃态物质,是混合物,没有固定的熔点,故B错误;
C.工业上生产玻璃的原料有:纯碱、石灰石和石英,故C正确;
D.制造水泥的主要原料是石灰石和黏土在高温条件下,在水泥回转窑中发生反应,硅酸盐:3CaO•SiO2、2CaO•SiO2、3CaO•Al2O3;即水泥的主要成分为:①硅酸三钙3CaO•SiO2,②硅酸二钙2CaO•SiO2,④铝酸三钙3CaO•Al2O3,故D错误.
故选C.
点评 本题考查玻璃、水泥的制取原料、成分等知识,属于基本知识的考查,平时注意基础知识的积累,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
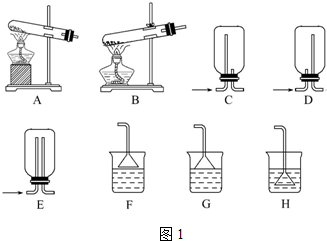
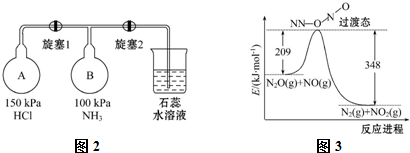
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 对于有气体参加的反应,增大压强,反应速率加快,是因为活化分子百分数增加 | |
| B. | 设NA为阿伏加德罗常数的值,500 mL 1mol/L氯化铁溶液中Fe3+的数目等于0.5NA | |
| C. | 常温下将干燥的pH试纸浸泡在0.01mol/L的NaOH溶液中来测溶液的pH,测得pH=12 | |
| D. | 要判断反应进行方向,须综合考虑体系的焓变和熵变,焓减且熵增的反应为自发反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
| A. | 1mol/L醋酸溶液加水稀释后,所有离子浓度均减小 | |
| B. | Na2CO3溶液中,一定有2c(Na+)=c(H2CO3)+c(HCO3-)+c(CO32-) | |
| C. | 等物质的量浓度的各溶液pH关系为:pH(Na2CO3)>pH(NaCN)>pH(CH3COONa) | |
| D. | 1 mol•L-1HCN溶液与1mol•L-1NaOH溶液等体积混合后,测得所得溶液显酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
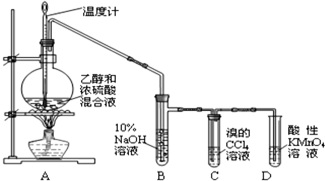
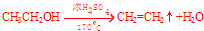 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 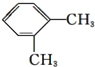 | B. |  | C. |  | D. | 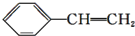 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com