
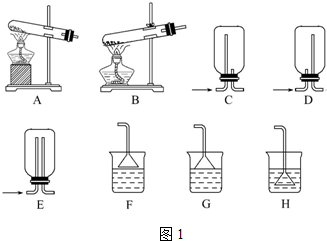
分析 (1)实验室用加热固体氯化铵和熟石灰制取氨气(2NH4Cl+Ca(OH)2?CaCl2+2NH3↑+2H2O),反应发生为固体与固体加热制取气体的装置,根据氨气为易溶于水密度比空气小的气体性质选择收集装置,氨气极易溶于水,尾气处理需考虑倒吸,据此分析解答;
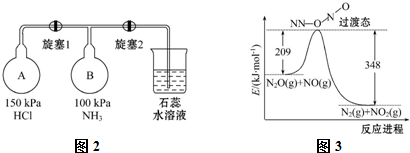
(2)①根据A、B容器压强以及A、B混合后压强相等以及氨气和氯化氢反应生成氯化铵分析;
②氨气、氯化氢为气体反应生成的氯化铵为固体,压强减小,氯化铵为强酸弱碱盐,溶液呈酸性,据此分析;
(3)氨水中的一水合氨为弱电解质,部分电离生成氢氧根离子;
(4)依据所给的反应物和产物,结合元素守恒书写方程式即可,依据氧化还原反应得失电子守恒计算转移电子数;
(5)由图可知,此反应为放热反应,△H=反应物总键能-生成物总键能;
解答 解:(1)实验室用加热固体氯化铵和熟石灰制取氨气(2NH4Cl+Ca(OH)2?CaCl2+2NH3↑+2H2O),反应发生为固体与固体加热制取气体的装置,因防止药品中的湿存水以及反应产生的水使反应试管受热不均匀,所以选择试管口向下的A装置制备氨气,氨气为易溶于水,不能用排水法收集,密度比空气小,需用向下排空气法收集,所以选择C装置,氨气极易溶于水,尾气处理需考虑倒吸,倒扣的漏斗空间大,水柱不易极速上升,能防止倒吸,故选G装置,
故答案为:ACG;
(2)①A容器压强为150KPa,B容器压强100KPa,A容器压强大于B容器,先打开旋塞1,A容器中的氯化氢进入B容器,氨气和氯化氢反应,NH3+HCl=NH4Cl,生成氯化铵固体小颗粒,所以B瓶中的现象是出现白烟,
故答案为:出现白烟;A瓶压强比B瓶大,氯化氢进入B瓶与氨气反应生成氯化铵固体小颗粒形成白烟;
②氨气、氯化氢为气体反应生成的氯化铵为固体,压强减小,再打开旋塞2,紫色的石蕊试液倒吸入B瓶中,氯化铵为强酸弱碱盐,溶液中铵根离子水解生成一水合氨和氢离子,水解方程式为:NH4++H2O?NH3•H2O+H+,溶液呈酸性,所以紫色石蕊试液变红,
故答案为:烧瓶中的液体倒吸入B瓶,且紫色石蕊试液变红;
(3)氨水中的一水合氨为弱电解质,部分电离生成氢氧根离子使溶液呈碱性,电离方程式:NH3•H2O?NH4++OH-;
故答案为:NH3•H2O?NH4++OH-;
(4)硝酸铵分解生成N2O和H2O,达到平衡,说明为可逆反应,化学反应方程式为:NH4NO3$\stackrel{△}{?}$N2O+2H2O;
NH4NO3中NH4+的N元素化合价为-3价,NO3-中的N元素的化合价为+5价,反应后N元素的化合价为+1价,发生归中反应,N元素由-3价升高为+1价,此反应中每分解1mol硝酸铵,转移电子数为4mol;
故答案为:NH4NO3$\stackrel{△}{?}$N2O↑+2H2O↑; 4;
(5)由图可知,此反应反应物总能量高于生成物,则△H=反应物总键能-生成物总键能=209-348=-139kJ•mol-1,
故答案为:-139.
点评 本题为综合题,考查了氨气的实验室制备及氨气的性质验证、反应热的计算,明确氨气制备原理及反应热计算方法是解题关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
| 元素 | 相关信息 |
| X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y | M层上有2对成对电子 |
| Z | Z和Y同周期,Z的电负性大于Y |
| W | W的一种核素的质量数为63,中子数为34 |
| J | J的气态氢化物与J的最高价氧化物对应的水化物可反应生成一种盐 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应的氧化剂是H2C2O4 | B. | 1molMnO4-在反应中失去5mol电子 | ||
| C. | 从反应中看出草酸性质很不稳定 | D. | 配平该反应后,H+的计量数是6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
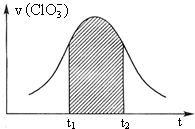 KClO3和KHSO3能发生反应(未配平):ClO3-+HSO3-→SO42-+Cl-+H+.该反应的速率v随c(H+)的增大而增大,如图是v (ClO3-)-t图.下列说法中不正确的是( )
KClO3和KHSO3能发生反应(未配平):ClO3-+HSO3-→SO42-+Cl-+H+.该反应的速率v随c(H+)的增大而增大,如图是v (ClO3-)-t图.下列说法中不正确的是( )| A. | 开始时反应速率增大可能是由c(H+)增大所致 | |
| B. | 纵座标为v(H+)的v-t曲线与右图曲线完全重合 | |
| C. | 后期反应速率下降的主要原因是反应物浓度减小 | |
| D. | 阴影部分面积可以表示t1-t2时间内c(Cl-)增加 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 55 kJ | B. | 220 kJ | C. | 550 kJ | D. | 1 108 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在相同温度下的溶解度:Na2CO3>NaHCO3 | |
| B. | 热稳定性:Na2CO3>NaHCO3>H2CO3 | |
| C. | 表示Na2CO3和NaHCO3分别与Ba(OH)2溶液反应的离子方程式相同 | |
| D. | 等质量的Na2CO3和NaHCO3分别与等浓度的HCl溶液完全反应,后者消耗的盐酸少 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 玻璃是人类是早使用的硅酸盐材料 | |
| B. | 玻璃在加热熔化时有固定的熔点 | |
| C. | 制普通玻璃的主要原料是纯碱、石灰石、石英 | |
| D. | 普通水泥的成分主要是硅酸钠、硅酸钙和二氧化硅 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com