
����Ŀ�������������ĺ��������Ϊ��ɫ��״���壬�����ڱ�ͪ���ȷºͱ��У��ڼ״����Ҵ������ѡ�ʯ�����п��ܽ⣬��ˮ�м������ܣ��۵�Ϊ156��157�������ȶ��Բ�������Ǹ�Ч�Ŀ�űҩ����֪�����ѷе�Ϊ35��������������ȡ�����صķ���֮һ������ȡԭ��Ϊ�����ģ���Ҫ�����ѽ�ȡ�������ͽ�ȡ�������ѽ�ȡ������Ҫ����Ϊ��
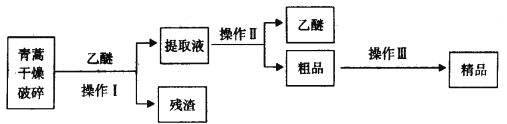
��ش��������⣺
��1����������и��������Ŀ����_____________��
��2������I��Ҫ�IJ���������Ҫ�У��ձ���_________����������������_______________��
��3������������Ҫ���̿�����_____________(����ĸ)��
A����ˮ�ܽ⣬����Ũ������ȴ�ᾧ
B����95�����Ҵ���Ũ�����ᾧ������
C���������ѽ�����ȡ��Һ
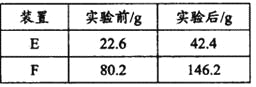
��4��������ʵ��װ�òⶨ�����ط���ʽ�ķ������£���28��2g��������Ʒ����Ӳ�ʲ�����C�У�����ͨ����������Ӻ��ٳ��ȼ�գ���ȷ�ⶨװ��E��Fʵ��ǰ��������������������ݼ��㡣
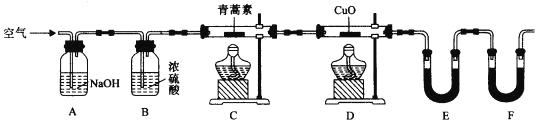
��װ��E��ʢ�ŵ�������______________��װ��F��ʢ�ŵ�������________________��
����ʵ��װ�ÿ��ܻ��������ɲⶨ������ƫ�ͣ��Ľ�������_______________��
���ú����Ľ����װ�ý������飬�Ƶã�
���������ص����ʽ��__________________��
��5��ijѧ���������ص����ʽ���̽�����������ؼ��뺬��NaOH����̪��ˮ��Һ�У������ص��ܽ�����С�����Ȳ����裬�����ص��ܽ�����������Һ��ɫ��dz��˵����������____________(����ĸ)������ͬ�����ʡ�
A���Ҵ� B������ C���������� D��������
��6��ij����С�龭�����ȡ������ʵ����Ϊ��ʯ�������ܼ���Ϊ���ˣ�ʵ����ͨ����������ʵ���������䣬���о�ԭ�ϵ����ȡ���ȡʱ�����ȡ�¶ȶ���������ȡ���ʵ�Ӱ�죬��������ͼ��ʾ��
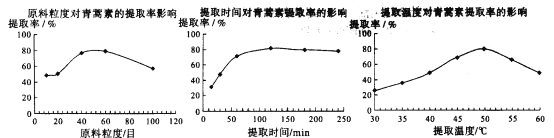
����ͼ��֪��������ʵ���������䣬���õ�������ȡ�ʱ����¶�Ϊ_______________��
A��80Ŀ��100���ӡ�50�� B��60Ŀ��120���ӡ�50�� C��60Ŀ��120���ӡ�55��
���𰸡���1���������������ѵĽӴ��������������صĽ�ȡ�ʡ�
��2��©���������� ���˻��ѹ���� ����
��3��B
��4����CaCl2��P2O5��ʯ�ң���������Ҳ������ ����װ��F������һ����ֹ�����е�CO2��ˮ��������F��װ�� ��C15H22O5
��5��C
��6��B
������������������������ѽ�ȡ�������̿�֪����������и������飬�����������������ѵĽӴ��������������صĽ�ȡ�ʣ������Ѷ������ؽ��н�ȡ���ˣ��ɵ���Һ����������ȡҺ���������ɵ������صĴ�Ʒ���Դ�Ʒ��95%���Ҵ���Ũ�����ᾧ�����˿ɵþ�Ʒ��
��1���������ѽ�ȡ�������̿�֪����������и������飬�����������������ѵĽӴ��������������صĽ�ȡ�ʣ��ʴ�Ϊ���������������ѵĽӴ��������������صĽ�ȡ�ʣ�
��2����������ķ���������IΪ���ˣ���Ҫ�IJ���������Ҫ�У��ձ���©�����������������������������ʴ�Ϊ��©����������������
��3����������ķ�����֪����Ʒ�м�95%���Ҵ���Ũ�����ᾧ�����˿ɵþ�Ʒ����ѡB��
��4��Ϊ����ȷ����������ȼ�����ɵ�CO2��H2O��ʵ��ǰӦͨ���ȥCO2��H2O�Ŀ������ų�װ���ڵĿ�������ֹ����ʵ�飮E��Fһ���������ɵ�H2O��һ���������ɵ�CO2��Ӧ����ˮ��������CO2������E��װ��CaCl2��P2O5����F��Ϊ��ʯ�ң�����F��Ӧ�ټ���һ��װ�÷�ֹ��������CO2����H2O�����װ�á�
����������ķ�����֪��װ��E��ʢ�ŵ������� CaCl2��P2O5��װ��F��ʢ�ŵ������� ��ʯ�ң��ʴ�Ϊ��CaCl2��P2O5����ʯ�ң�
����ʵ��װ�ÿ��ܻ��������ɲⶨ������ƫ�ͣ��Ľ������� ��װ��F������һ����ֹ�����е�CO��ˮ��������F��װ�ã��ʴ�Ϊ����װ��F������һ����ֹ�����е�CO��ˮ��������F��װ�ã�
�������ݿ�֪ m(H2o)=42.4-22.6=19.8g������n(H2o)=1.1mol��m(co2)=146.2-80.2=66g������ n(co2)=1.5mol����������������ԭ�ӵ�����Ϊm(o)=28.2-(2.2��1)-(1.5��12)=6g������n(o)=0.5mol��N(C)��N(H)��N(o)=1.5��2.2��0.5=15��22��5������C15H22O5���ʴ�Ϊ��C15H22O5��
��5��������������ˮ����������������Һ��ˮ�Ⲣ�����������ƽ�������֪���������к�����������ѡC��
��6������ԭ�ϵ����ȶ���������ȡ���ʵ�Ӱ���֪��ӦΪ60Ŀ��������ȡʱ�����������ȡ���ʵ�Ӱ���֪��ʱ��ӦΪ120���ӣ�������ȡ�¶ȶ���������ȡ���ʵ�Ӱ���֪���¶�ӦΪ50������ѡB��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʳ���к���һ������þ���������ʣ��ӵ����е����ʧ��Ҫ���������ʡ�ˮ�֡������е������Լ����ա����ȶ����������֪��
�����ԣ�IO3����Fe3+��I2����ԭ�ԣ�S2O32����I����3I2+6OH���TIO3��+5I��+3H2O��KI+I2![]() KI3
KI3
ijѧϰС��Լӵ��ν�������ʵ�飺ȡһ����ij�ӵ��Σ����ܺ���KIO3��KI��Mg2+��Fe3+��������������ˮ�ܽ⣬����ϡ�����ữ����������Һ��Ϊ3�ݣ���һ����Һ�еμ�KSCN��Һ���Ժ�ɫ���ڶ�����Һ�м�����KI���壬��Һ�Ե���ɫ����CCl4��ȡ���²���Һ���Ϻ�ɫ����������Һ�м�������KIO3����μӵ����Լ�����Һ����ɫ��
��1������һ����Һ�еμ�KSCN��Һ�Ժ�ɫ���ú�ɫ������ ���û�ѧʽ��ʾ����
���ڶ�����Һ�м�������KI�����Ӧ�����ӷ���ʽΪ �� ��
��2����KI��Ϊ�ӵ����ʳ���ڱ�������У����ڿ��������������ã�������������ʧ��д����ʪ������KI��������Ӧ�Ļ�ѧ����ʽ�� ��
����I2����KI��Һ���ڵ��������£����Ƶ�KI3H2O����������Ϊʳ�μӵ���Ƿ���ʣ� ����ǡ�������˵������ ��
��3������6mol KI��������Һ����μ���KBrO3��Һ�����������к������ʵ����ʵ���������KBrO3�����ʵ����Ĺ�ϵ��ͼ��ʾ����ش��������⣺
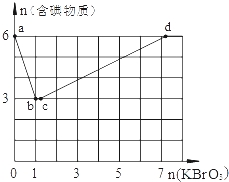
����֪b��ʱ��KI��Ӧ��ȫ��ת�Ƶĵ�����Ϊ ��
��b��c�����У�����һ��Ԫ�صĻ��ϼ۷����˱仯����Ӧʱ�������뻹ԭ�������ʵ���֮��Ϊ ��
��d��ʱ��n��KBrO3��Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������泥�NH2COONH4,��Ƽ�泥���CO2��NH3�����ص��м�������CO2��Ӧ���ɼ�淋������仯����ͼ��ʾ��
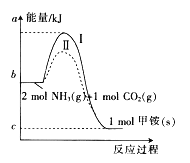
��1��ͼ�з�ӦΪ���淴Ӧ�������ɼ�淋ķ�Ӧ�� ��������������������������Ӧ��
��2���ϳɼ�淋��Ȼ�ѧ����ʽΪ ��
��3������ͬһ��Ӧ��ͼ�����ߣ�������ʵ�ߣ�������ȣ���ܴ�ͣ���ԭ���� ��
��4����֪�ɼ�狀ϳ����صķ�ӦΪNH2COONH4��s��![]()
![]() ��
��![]() ������CO2(g)��NH3��g��ֱ�Ӻϳɹ�̬���ز�����Һ̬ˮ���Ȼ�ѧ����ʽΪ ��
������CO2(g)��NH3��g��ֱ�Ӻϳɹ�̬���ز�����Һ̬ˮ���Ȼ�ѧ����ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ԭ�������ĵ��������ֶ�����Ԫ��(����ĸx�ȱ�ʾ)ԭ�Ӱ뾶����Դ�С��������ۻ�����۵ı仯��ͼ��ʾ�������жϳ���Ԫ�ػش����⣺
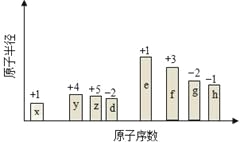
��1��f��Ԫ�����ڱ���λ����____________________________��
��2���Ƚ�d��e�������ӵİ뾶��С______��______���û�ѧʽ��ʾ����ͬ�����Ƚ�g��h������������Ӧ��ˮ���������ǿ��___________��____________��
��3����ѡ����Ԫ�����һ����ԭ�ӹ��ۻ����д�������ʽ______________________��
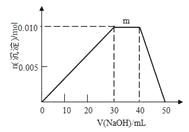
��4������Ԫ�ؿ������R��zx4f(gd4)2����ʢ��10 mL 1 mol��L-1 R��Һ���ձ��еμ�1 mol��L-1 NaOH��Һ���������ʵ�����NaOH��Һ����仯��ͼ��ʾ��
�� д��m�η�Ӧ�����ӷ���ʽ_______________________________��
�� ����R��Һ�иļ�20 mL 1.2 mol��L-1Ba(OH)2��Һ����ַ�Ӧ����Һ�в������������ʵ���Ϊ___________mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����û�ѧ��Ӧԭ���о�̼�����ĵ��ʼ��仯����ķ�Ӧ�Ի������Ⱦ����ԴΣ��������Ҫ���塣
��1����֪��ӦCO(g)��2H2(g)![]() CH3OH(g) ��H=-99kJ��mol-1�е���ػ�ѧ�������£�
CH3OH(g) ��H=-99kJ��mol-1�е���ػ�ѧ�������£�
![]()
��x= ��
��2���״���Ϊһ����Ҫ�Ļ���ԭ�ϣ��ȿ�����Ϊȼ�ϣ��������ںϳ���������ԭ�ϡ���һ�������¿����ü״��ʻ�������ȡ����������䷴Ӧԭ���ɱ�ʾΪ��CH3OH(g) ��CO(g) ![]() HCOOCH3(g) ��H=-29.1kJ��mol-1�������Ϊ2L���ܱ������г���2mol CH3OH(g) ��2mol CO����������ڵ�ѹǿ(p��kPa)��ʱ��(min)�ı仯��ϵ����ͼ�Т�������ʾ��
HCOOCH3(g) ��H=-29.1kJ��mol-1�������Ϊ2L���ܱ������г���2mol CH3OH(g) ��2mol CO����������ڵ�ѹǿ(p��kPa)��ʱ��(min)�ı仯��ϵ����ͼ�Т�������ʾ��

�٢�͢���ȣ��ı�ķ�Ӧ������ ��
�ڷ�Ӧ����5minʱ�ﵽƽ�⣬�ڴ������´ӷ�Ӧ��ʼ���ﵽƽ��ʱv(HCOOCH3)= ��
�۷�Ӧ����2minʱ�ﵽƽ�⣬ƽ�ⳣ��K(��) = ����������¶Ȳ���������£���������Ӧ�ﵽƽ���ʱ�����������м���1mol CO��2mol HCOOCH3��v(��) v(��)�����������������������ԭ���� ��
���ȽϷ�Ӧ����¶�(T1)�ͷ�Ӧ����¶�(T3)�ĸߵͣ�T1 T3������������������������жϵ������� ��
��3�������ٷɻ���ƽ�������ʱ��β���е�NO���ƻ������㡣��ѧ�������о����ô�������β���е�NO��COת���CO2��N2��ij�о�С����ʵ������ij���ʹ�����CO��NO��ת�������о������NOת��ΪN2��ת�������¶ȡ�CO������ı仯�������ͼ��ʾ���������·�Ӧ��գ�
NO+CO![]() N2+ CO2����CO�� 2NO
N2+ CO2����CO�� 2NO![]() N2+ O2����CO��
N2+ O2����CO��
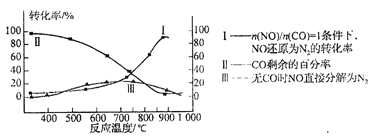
������ʹ��CO���¶ȳ���775��������NO�ķֽ��ʽ��ͣ�����ܵ�ԭ��Ϊ ��
����n(NO)/ n(CO)=1�������£�Ӧ��������¶��� ���ҡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Դ�����þ��й���ǰ����
��1����ͼ�ǴӺ�ˮ����ȡþ�ļ����̣�
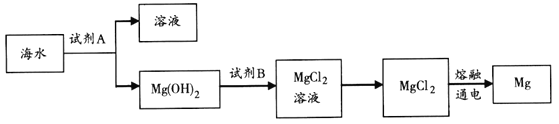
�ٹ�ҵ�ϳ����ڳ���Mg2+���Լ�A��________��Mg(OH)2ת��ΪMgCl2�����ӷ���ʽ��_______��
������ˮMgCl2��ȡMg�Ļ�ѧ����ʽ��________��
��2���������и�����I����ʽ���ڵĵ�Ԫ�أ�ʵ������ȡI2��;��������ʾ��
![]()
�����պ������ҽ�ʱ���õ���Ҫ����������________��
�����ữ����Һ�мӹ���������Һ��д���÷�Ӧ�����ӷ���ʽ________��
�۷�Ӧ��������CCl4����ȡ����������ȡ����Һ�ķ����ӵ�ˮ����ȡ�⣬��Ҫ����������ͼ��
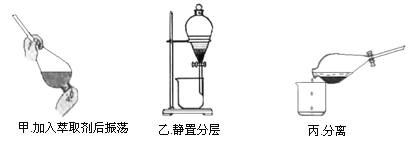
�ס��ҡ���3��ʵ������У�����ȷ����________����ס������ҡ���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�������̿�(MnCO3)�ۺ�FeCO3��SiO2��Cu2(OH) 2CO3�����ʣ�Ϊԭ����ȡ�������̣�������ʾ��ͼ���£�
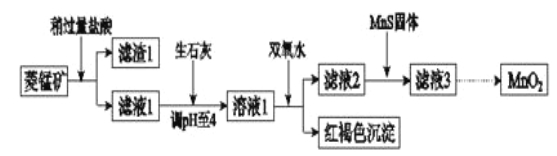
��֪�������������������pH
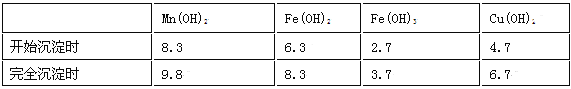
ע���������ӵ���ʼŨ��Ϊ0.1 mol/L,�ش��������⣺
��1�������ʵ����̿�ʹ��ǰ�轫����飬��ҪĿ���� _______ ___________ �������ܽ�MnCO3�Ļ�ѧ����ʽ��_______ ______________ ___ _____��
��2������Һ1�м���˫��ˮʱ����Ӧ�����ӷ���ʽ�� _______ ___________ ��
��3����Һ2�м����Թ��������ܵ����MnS���Գ�ȥCu2+����Ӧ�����ӷ���ʽ�� ________ ��
��4����MnCl2ת��ΪMnO2��һ�ַ���������������������������ữ��NaClO3��Һ��MnCl2�������÷�Ӧ�����ӷ���ʽΪ����Mn2������ClO3������________����________����________����________��
��5����MnCl2ת��ΪMnO2����һ�ַ����ǵ�ⷨ��
�� ��������MnO2�ĵ缫��Ӧʽ�� ____ ___ ____________ _______ ��
����ֱ�ӵ��MnCl2��Һ������MnO2��ͬʱ���������Cl2������Cl2�IJ����� _____ ��
����������MnCl2��Һ�м���һ������Mn(NO3)2��ĩ������Cl2��������ԭ���� ___ __ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪X��Y��Z��W����Ԫ����Ԫ�����ڱ�������������ͬ�����ڵ�Ԫ�أ���ԭ��������������X��Wͬ���壬Y��ZΪͬ���ڵ�����Ԫ�ء�Wԭ�ӵ�����������Y��Zԭ������������֮�͡�Y���⻯���������3�����ۼ���Zԭ�������������Ǵ�����������3�������ƶϣ�
��1��X��Y��Z��W����Ԫ�صķ��ţ�
X___________��Y___________��Z___________��W___________��
��2��������Ԫ���е�����Ԫ����ɵ�������ˮ��ˮ��Һ�Լ��ԵĻ�����ĵ���ʽ�ֱ�
Ϊ_____________��___________________��
��3����X��Y��Z���γɵ����ӻ�������_____________�����ѧʽ������W������������ˮ�����Ũ��Һ����ʱ�����ӷ���ʽ��____________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л���A��C10H20O2������������ζ��������������ϴ���㲨�ķ��㸳�����

��֪����B������û��֧����
��D����̼��������Һ��Ӧ�ų�������̼��
��D��E��Ϊ������ͬ�����ŵ�ͬ���칹�塣E���������ϵ���������ԭ��ȡ������һ�ȴ���ֻ��һ�֡�
��F����ʹ������Ȼ�̼��Һ��ɫ��
��1��B���Է����ķ�Ӧ�� ��ѡ����ţ���
a��ȡ����Ӧ b����ȥ��Ӧ c���Ӿ۷�Ӧ d��������Ӧ
��2��C��D��F���������Ĺ����ŵ�����������
��3��д��E�Ľṹ��ʽ��
��4��д��C��D�Ļ�ѧ����ʽ��
��5��д��B��F�Ļ�ѧ����ʽ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com