
����Ŀ��ʳ���к���һ������þ���������ʣ��ӵ����е����ʧ��Ҫ���������ʡ�ˮ�֡������е������Լ����ա����ȶ����������֪��
�����ԣ�IO3����Fe3+��I2����ԭ�ԣ�S2O32����I����3I2+6OH���TIO3��+5I��+3H2O��KI+I2![]() KI3
KI3
ijѧϰС��Լӵ��ν�������ʵ�飺ȡһ����ij�ӵ��Σ����ܺ���KIO3��KI��Mg2+��Fe3+��������������ˮ�ܽ⣬����ϡ�����ữ����������Һ��Ϊ3�ݣ���һ����Һ�еμ�KSCN��Һ���Ժ�ɫ���ڶ�����Һ�м�����KI���壬��Һ�Ե���ɫ����CCl4��ȡ���²���Һ���Ϻ�ɫ����������Һ�м�������KIO3����μӵ����Լ�����Һ����ɫ��
��1������һ����Һ�еμ�KSCN��Һ�Ժ�ɫ���ú�ɫ������ ���û�ѧʽ��ʾ����
���ڶ�����Һ�м�������KI�����Ӧ�����ӷ���ʽΪ �� ��
��2����KI��Ϊ�ӵ����ʳ���ڱ�������У����ڿ��������������ã�������������ʧ��д����ʪ������KI��������Ӧ�Ļ�ѧ����ʽ�� ��
����I2����KI��Һ���ڵ��������£����Ƶ�KI3H2O����������Ϊʳ�μӵ���Ƿ���ʣ� ����ǡ�������˵������ ��
��3������6mol KI��������Һ����μ���KBrO3��Һ�����������к������ʵ����ʵ���������KBrO3�����ʵ����Ĺ�ϵ��ͼ��ʾ����ش��������⣺
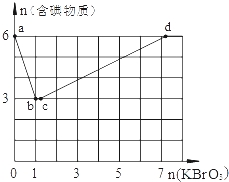
����֪b��ʱ��KI��Ӧ��ȫ��ת�Ƶĵ�����Ϊ ��
��b��c�����У�����һ��Ԫ�صĻ��ϼ۷����˱仯����Ӧʱ�������뻹ԭ�������ʵ���֮��Ϊ ��
��d��ʱ��n��KBrO3��Ϊ ��
��������1����Fe��SCN��3 ��IO3-��5I����6H����3I2��3H2O��2Fe3����2I����2Fe2����I2
��2����O2��4KI��2H2O��2I2��4KOH
�ڷ�KI3���ȣ���ʪ��������KI��I2��KI�ױ���������ΪI2��I2����������
��3����6NA����3.612��1024����1��5 ��7.2mol
��������
�����������1���ټ�KSCN��Һ���Ժ�ɫ�������ķ�ӦΪ��Fe3����3SCN����Fe��SCN��3��
�������Ϸ�����֪���ӵ����к���Fe3����IO3-����Һ�м�������KI������������ӷ�ӦΪ��IO3-��5I����6H����3I2��3H2O,2Fe3����2I����2Fe2����I2��
��2����KI���л�ԭ�ԣ��ڳ�ʪ�Ļ�������O2����������ԭ��Ӧ��O2��4KI��2H2O��2I2��4KOH��
����������Ϣ��֪��KI3��H2O�����ȣ���ʪ���������·�����ӦKI3![]() KI��I2����KI�ױ���������ΪI2����I2�������������Ӷ���������ʧ����KI3��H2O���ʺ���ʳ�μӵ����
KI��I2����KI�ױ���������ΪI2����I2�������������Ӷ���������ʧ����KI3��H2O���ʺ���ʳ�μӵ����
��3������֪b��ʱ��KI��Ӧ��ȫ����Ӧ�����ĺ��е�Ԫ�ص����ʵ�����3mol��˵����Ӧ������I2��6molKI������Ӧ����3mol��I2��Ӧ����ʽ�ǣ�6I-+BrO3-+6H+��3I2+Br-+3H2O��ת�Ƶĵ�����Ϊ6NA��
��b��c�����У�����һ��Ԫ�صĻ��ϼ۷����˱仯����Ӧ����Br-��BrO3-֮�䷢��������ԭ��Ӧ����Ӧ�����ӷ���ʽ�ǣ�5Br-+BrO3-+6H+��3Br2+3H2O,��ʱ�������뻹ԭ�������ʵ���֮��Ϊ1:5��
�۷����ķ�Ӧ�����ǣ�6I-+6H++BrO3-��3I2+Br-+3H2O��BrO3-+5Br-+6H+��3Br2+3H2O��BrO3-+I2��2IO3-+Br2���ܷ�Ӧ����ʽ�ǣ�5I-+6H++6BrO3-��5IO3-+3Br2+3H2O�����ݷ���ʽ��֪6molKI��ȫ��Ӧ����Ҫ����KBrO3�����ʵ�����6mol��6/5��7.2mol������d��ʱ��n��KBrO3����7.2mol��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�о�С���������̿�(��Ҫ�ɷ�ΪMnO2��������������������ͭ�����Ƚ���������)���������ͨ�����¼������ѳ�ȼúβ���е�SO2��ͬʱ�Ƶõ�ز���MnO2(��Ӧ������ʡ��)��

��ش��������⣺
��1�����������ж���漰�����˲�����ʵ���ҽ��й��˲���ʱ��Ҫ�õ��Ĺ����������в������� �� �����в������������� ��
��2����MnCO3�ܳ�ȥ��Һ�е�Al3����Fe3������ԭ���� ��
��3����֪Ksp(CuS)��8.4��10��45��Ksp(NiS)��1.4��10��24���ڳ�ͭ���Ĺ����У���Ni2��ǡ����ȫ���� (��ʱ��Һ��c(Ni2��)��1.0��10��5mol/L)����Һ��Cu2����Ũ���� mol/L��
��4����ҵ�ϲ��ö��Ե缫���K2MnO4ˮ��Һ�ķ���������KMnO4����д�������ĵ缫��Ӧʽ ������ܷ�Ӧ�Ļ�ѧ����ʽ ��
��5�����и����Լ��У���ȷ�ⶨһ�����ȼúβ����SO2��������_________��(����)
a��NaOH��Һ����̪��Һ b��ϡH2SO4�ữ��KMnO4��Һ
c����ˮ��������Һ d����ˮ����̪��Һ
��6�����Ӻ�õ���MnSO4��Һ����ͨ�� �Ƶ������̾��塣(MnSO4H2O����Է�������Ϊ169)
a������ b������Ũ�� c����ȴ�ᾧ d������
��7����֪������SO2Ũ��Ϊ8.4 g/m3�����̿�SO2�������ʿɴ�90%������1000 m3ȼúβ�����ɵõ������̾�������Ϊ kg(�������3λ��Ч����)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������![]() ��һ�ֹ�ҵ�Ͼ�����Ҫ������л���Ԫ�ᣬ�ڻ����������л��ϳɹ�ҵ��ҽҩ��������ȷ��涼����Ҫ���ã��ܹ��������η�Ӧ���ữ��Ӧ�ȣ��������Ԫ�����۳ɸ߷��Ӿۺ���ȣ���������������ж�Ԫ�����еĵڶ�λ��ʵ���Һϳɼ�����ķ�Ӧԭ����ʵ��װ��ʾ��ͼ���£�
��һ�ֹ�ҵ�Ͼ�����Ҫ������л���Ԫ�ᣬ�ڻ����������л��ϳɹ�ҵ��ҽҩ��������ȷ��涼����Ҫ���ã��ܹ��������η�Ӧ���ữ��Ӧ�ȣ��������Ԫ�����۳ɸ߷��Ӿۺ���ȣ���������������ж�Ԫ�����еĵڶ�λ��ʵ���Һϳɼ�����ķ�Ӧԭ����ʵ��װ��ʾ��ͼ���£�![]()
�����õ����й��������£�
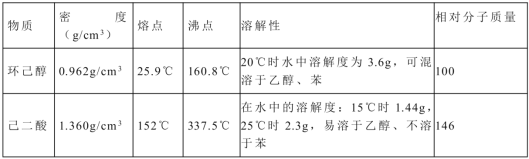
ʵ�鲽�����£�
������������ƿ�м���16mL 50%�����ᣨ�ܶ�Ϊ1.31g/cm�����ټ���1��2����ʯ����Һ©����ʢ����5.4mL��������
����ˮԡ����������ƿ��50�����ң���ȥˮԡ�������μ�5��6�λ�������ҡ��������ƿ���۲쵽�к���ɫ����ų�ʱ�������μ�ʣ�µĻ�������ά�ַ�Ӧ�¶���60����65 ��֮�䡣
������������ȫ��������������80��-90��ˮԡ����Լ10min��ע������¶ȣ���ֱ������ɫ��������Ϊֹ��
�������Ƚ���ӦҺ�����ձ��У������ˮԡ����ȴ�������������ˡ�ϴ�ӵôֲ�Ʒ��
�����ֲ�Ʒ���ᴿ�����Ϊ5.7g��
��ش��������⣺
��1����Һ©����ϸ֧��a��������________������b������Ϊ________��
��2����֪��NaOH��Һ����β��ʱ��������ط�Ӧ����ʽΪ��2NO2+2NaOH=NaNO2 +NaNO3 +H2O
NO+NO2+2NaOH =2NaNO2+H2O��������ô�����Һ����β��ʱҲ�ܷ������Ʒ�Ӧ������ط�Ӧ����ʽΪ��_________________��__________________��
��3����������ƿ�еμӻ�����ʱ��Ҫ���ƺû������ĵ������ʣ���ֹ��Ӧ���ھ��ҵ����¶�Ѹ�����������������ɽ����صĺ�������о�һ�����ܲ����ĺ����_________________________________��
��4��Ϊ�˳�ȥ���ܵ����ʺͼ��ٲ�Ʒ��ʧ���ɷֱ��ñ�ˮ��________ϴ�Ӿ��塣
��5���ֲ�Ʒ����________���ᴿ(��ʵ���������)����ʵ�����õ��ļ��������Ϊ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������װ���У�MSO4��NSO4�����ֳ��������������Ρ���K�պ�ʱ��SO���ҵ���ͨ������Ĥ����M�������з�����ȷ����( )
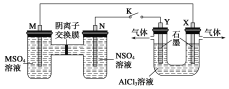
A����Һ��c(M2��)��С
B��N�ĵ缫��Ӧʽ��N-2e��===N2��
C��X�缫����H2������������ԭ��Ӧ
D����Ӧ������Y�缫��Χ���ɰ�ɫ��״����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ�����ö�������(CeO2)��̫���������½�H2O��CO2ת���H2��CO����������£�mCeO2![]() (m-x)CeO2��xCe+xO2
(m-x)CeO2��xCe+xO2
(m-x)CeO2��xCe+xH2O+ xCO2![]() mCeO2+ xH2+ xCO
mCeO2+ xH2+ xCO
����˵������ȷ����( )
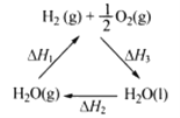
A���ù�����CeO2û������
B���ù���ʵ����̫������ѧ�ܵ�ת��
C����ͼ����H1=��H2+��H3
D����CO��O2���ɵļ���ȼ�ϵ�صĸ�����ӦʽΪCO+4OH����2e��=CO32-+2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪A��һ����Ҫ�Ļ�������ԭ�ϣ��������̼Ԫ�صİٷֺ���Ϊ85.7%������Է�����С��30��A��B��C��D��E��F��G��H����ͼ��ʾ��ת����ϵ�����ֲ�������ȥ��������BΪ�߷��ӻ����CΪ��ɫ��ζ���壬ʵ�����п���ͨ��G�����ʯ��ȡ��DΪ��������ʹ���Ը��������Һ��ɫ��E��GΪ�����г������л����E��������ζ��H����ζ��
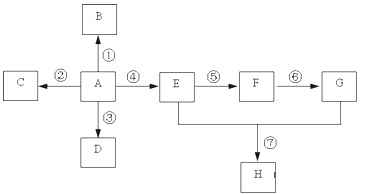
��1��д�����и����ʵĹ����ŵ����ƣ�A ___________��E ___________��
��2����Ҫ��д�����и����仯�Ļ�ѧ����ʽ��ע����Ӧ������
��Ӧ��_____________________________________________________��
��Ӧ��_____________________________________________________��
��Ӧ�� _____________________________________________________��
��3��д�����з�Ӧ���ͣ���Ӧ�� ___________����Ӧ��___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����淴Ӧ��2NO2![]() 2NO+O2 �ں����ܱ������з�Ӧ���ﵽƽ��״̬�ı�־��( )
2NO+O2 �ں����ܱ������з�Ӧ���ﵽƽ��״̬�ı�־��( )
�ٵ�λʱ��������n molO2��ͬʱ����2n molNO2��
�ڵ�λʱ��������n molO2 ��ͬʱ����2n mol NO��
����NO2��NO��O2 �����ʵ���Ũ�ȱ仯��ʾ�ķ�Ӧ���ʵı�Ϊ2��2��1��״̬��
�ܻ��������![]() ���䣻
���䣻
�ݻ���������ɫ���ٸı��״̬��
���������ܶȲ��ٸı��״̬��
��������ƽ����Է����������ٸı��״̬��
A���٢ݢ� B���٢ܢݢ� C���٢ݢޢ� D���٢ۢݢޢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I����ϩ�������ѽ�������Ҫ�ɷ֣����IJ���ͨ����������һ�����ҵ�ʯ�ͻ���ˮƽ��
��ͼ��ʯ�����ڳ������Ƭ�������²�����ϩ�����������ʵ�ʵ�飬����������⡣
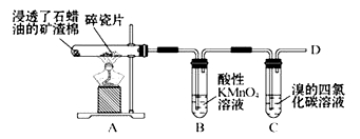
��1��A�����Ƭ�������� ��
��2��B�з�Ӧ������ ��C��ʵ�������� ��
II������CH4��C2H4��C6H6�������������
��3��������������������ȫȼ��ʱ��ȥO2����������__________�����ɶ�����̼������__________������ˮ������_________��
III.��4������ʽΪC9H12�ı���ͬϵ���� �֣����ڱ����Ϸ���������Ӧʱ�����ɵ�һ����ȡ����ֻ��һ�֣������Ľṹ��ʽΪ ��
��5�������к���22 �����ۼ��������������ķ���ʽ�� ��
��6��֧��ֻ��һ���һ���ʽ����С�������Ľṹ��ʽ ��������Ϊ ��
��7����ij����������������Ӧ�����һ��������4 ����3.6g ������ȫ����һ������ʱ���ų�������������ˮ��ȫ���գ�������Һ��0.1 mol��L-1NaOH ��Һ500mLǡ���к�����������ķ���ʽΪ ����ṹ��ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ĺ��������Ϊ��ɫ��״���壬�����ڱ�ͪ���ȷºͱ��У��ڼ״����Ҵ������ѡ�ʯ�����п��ܽ⣬��ˮ�м������ܣ��۵�Ϊ156��157�������ȶ��Բ�������Ǹ�Ч�Ŀ�űҩ����֪�����ѷе�Ϊ35��������������ȡ�����صķ���֮һ������ȡԭ��Ϊ�����ģ���Ҫ�����ѽ�ȡ�������ͽ�ȡ�������ѽ�ȡ������Ҫ����Ϊ��
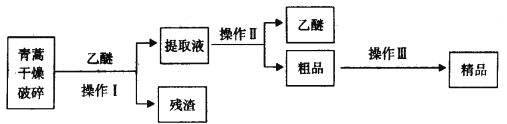
��ش��������⣺
��1����������и��������Ŀ����_____________��
��2������I��Ҫ�IJ���������Ҫ�У��ձ���_________����������������_______________��
��3������������Ҫ���̿�����_____________(����ĸ)��
A����ˮ�ܽ⣬����Ũ������ȴ�ᾧ
B����95�����Ҵ���Ũ�����ᾧ������
C���������ѽ�����ȡ��Һ
��4��������ʵ��װ�òⶨ�����ط���ʽ�ķ������£���28��2g��������Ʒ����Ӳ�ʲ�����C�У�����ͨ����������Ӻ��ٳ��ȼ�գ���ȷ�ⶨװ��E��Fʵ��ǰ��������������������ݼ��㡣
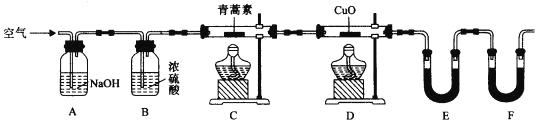
��װ��E��ʢ�ŵ�������______________��װ��F��ʢ�ŵ�������________________��
����ʵ��װ�ÿ��ܻ��������ɲⶨ������ƫ�ͣ��Ľ�������_______________��
���ú����Ľ����װ�ý������飬�Ƶã�
���������ص����ʽ��__________________��
��5��ijѧ���������ص����ʽ���̽�����������ؼ��뺬��NaOH����̪��ˮ��Һ�У������ص��ܽ�����С�����Ȳ����裬�����ص��ܽ�����������Һ��ɫ��dz��˵����������____________(����ĸ)������ͬ�����ʡ�
A���Ҵ� B������ C���������� D��������
��6��ij����С�龭�����ȡ������ʵ����Ϊ��ʯ�������ܼ���Ϊ���ˣ�ʵ����ͨ����������ʵ���������䣬���о�ԭ�ϵ����ȡ���ȡʱ�����ȡ�¶ȶ���������ȡ���ʵ�Ӱ�죬��������ͼ��ʾ��
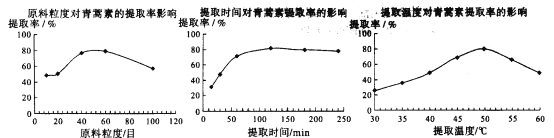
����ͼ��֪��������ʵ���������䣬���õ�������ȡ�ʱ����¶�Ϊ_______________��
A��80Ŀ��100���ӡ�50�� B��60Ŀ��120���ӡ�50�� C��60Ŀ��120���ӡ�55��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com