
����Ŀ�����淴Ӧ��2NO2![]() 2NO+O2 �ں����ܱ������з�Ӧ���ﵽƽ��״̬�ı�־��( )
2NO+O2 �ں����ܱ������з�Ӧ���ﵽƽ��״̬�ı�־��( )
�ٵ�λʱ��������n molO2��ͬʱ����2n molNO2��
�ڵ�λʱ��������n molO2 ��ͬʱ����2n mol NO��
����NO2��NO��O2 �����ʵ���Ũ�ȱ仯��ʾ�ķ�Ӧ���ʵı�Ϊ2��2��1��״̬��
�ܻ��������![]() ���䣻
���䣻
�ݻ���������ɫ���ٸı��״̬��
���������ܶȲ��ٸı��״̬��
��������ƽ����Է����������ٸı��״̬��
A���٢ݢ� B���٢ܢݢ� C���٢ݢޢ� D���٢ۢݢޢ�
���𰸡�B
��������
�����������ٸ��ݵ�λʱ��������nmolO2��ͬʱ����2nmol NO2 ����֪�������������ʺ�����������ȣ��ﵽ��ƽ��״̬���ʢ���ȷ���ڵ�λʱ��������nmolO2��ͬʱ����2nmol NO����������Ӧ���ʣ����ж��Ƿ�ﵽƽ�⣬�ʢڴ������κ�����£�ͬһ��Ӧ����ͬһʱ�������NO2��NO��O2 �����ʵ���Ũ�ȱ仯��ʾ�ķ�Ӧ���ʵıȾ�Ϊ2��2��1���������ͬһ��Ӧ����ֻ�дﵽƽ����ͬʱ�ŷ��ϸñ�ֵ���ʢ۴��ܻ��������![]() ������˵�������ʵĺ������ٱ仯����Ӧ�Ѵﵽƽ��״̬��������ȷ�������������ɫ���ٸ��䣬˵�����ɵĶ������������ĵ�������ȣ���Ӧ�ﵽ��ƽ��״̬���ʢ���ȷ������Ӧǰ�����������������䡢����������䣬���Ի��������ܶ�ʼ�ղ��䣬�����жϷ�Ӧ�ﵽƽ��״̬��������������Ӧ��������ﶼ�����壬��Ӧǰ�������������䣬���ʵ�����ͬ��ƽ����Է����������ٸı䣬˵����Ӧ�ﵽƽ��״̬��������ȷ������������ѡ��B��ȷ��
������˵�������ʵĺ������ٱ仯����Ӧ�Ѵﵽƽ��״̬��������ȷ�������������ɫ���ٸ��䣬˵�����ɵĶ������������ĵ�������ȣ���Ӧ�ﵽ��ƽ��״̬���ʢ���ȷ������Ӧǰ�����������������䡢����������䣬���Ի��������ܶ�ʼ�ղ��䣬�����жϷ�Ӧ�ﵽƽ��״̬��������������Ӧ��������ﶼ�����壬��Ӧǰ�������������䣬���ʵ�����ͬ��ƽ����Է����������ٸı䣬˵����Ӧ�ﵽƽ��״̬��������ȷ������������ѡ��B��ȷ��


 ��ʱѵ���������������ϵ�д�
��ʱѵ���������������ϵ�д� �ƸԾ���Ȥζ����ϵ�д�
�ƸԾ���Ȥζ����ϵ�д� ����С����ҵ��ϵ�д�
����С����ҵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NO2��CO��CO2�ǶԻ���Ӱ��ϴ�����壬�����ǵĺ������ơ��������Ż��������滷������Ч;����
��1����ͼ��ʾ�����õ绯ѧԭ����NO2 ת��Ϊ��Ҫ����ԭ��C��
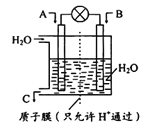
��AΪNO2��BΪO2�����ĵ缫��ӦʽΪ______________________________��
��2����һ����CO2�����״�ȼ�ϵķ�����
CO2��3H2![]() CH3OH��H2O
CH3OH��H2O
��֪��
CO2(g)��3H2(g)![]() CH3OH(g)��H2O(g) ��H����a kJ��mol��1��
CH3OH(g)��H2O(g) ��H����a kJ��mol��1��
2H2(g)��O2(g)��2H2O(g) ��H����b kJ��mol��1��
H2O(g)��H2O(l) ��H����c kJ��mol��1��
CH3OH(g)��CH3OH(l) ��H����d kJ��mol��1��
���ʾCH3OH(l)ȼ�������Ȼ�ѧ����ʽΪ��_________________________________��
��3������ (COCl2)��һ����Ҫ�Ļ���ԭ�ϣ�����ũҩ��ҽҩ����������ϵ���������ҵ��ͨ��Cl2(g)��CO(g) ![]() COCl2(g)�Ʊ�����ͼΪ�˷�Ӧ�ķ�Ӧ�������¶ȱ仯�����ߣ���ͼΪij��ģ��ʵ���о������������ڸ����ʵ�Ũ����ʱ��仯�����ߡ��ش��������⣺
COCl2(g)�Ʊ�����ͼΪ�˷�Ӧ�ķ�Ӧ�������¶ȱ仯�����ߣ���ͼΪij��ģ��ʵ���о������������ڸ����ʵ�Ũ����ʱ��仯�����ߡ��ش��������⣺
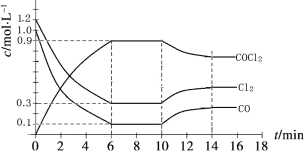
��0~6 min�ڣ���Ӧ��ƽ������v(Cl2)�� ��
���������¶Ȳ��䣬�ڵ�7min ����ϵ�м������������ʸ�2mol����ƽ����____________________
�ƶ�(����������Ӧ�������������淴Ӧ��������������)��
��������ʼͶ��Ũ�ȱ�Ϊc(Cl2)=0.7mol/L��c(CO)=0.5mol/L��c(COCl2)_________ mol/L�����ַ�Ӧ�¶Ȳ��䣬�����մﵽ��ѧƽ��ʱ��Cl2�����������������6minʱCl2�����������ͬ��
�����¶����ߣ��÷�Ӧƽ�ⳣ���仯��������__________��(����������������С������������)
���Ƚϵ�8min��Ӧ�¶�T��8�����15min��Ӧ�¶�T(15)�ĸߵͣ�T��8��_______T(15)(��������������������=��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ӡ���ɽ�緢��������׳�۵����������������ľ���������ʲƸ������������ð������Σ���ڵײ��Ļ�ɽ���ռ�����ǿ���ȡ������롣��ǿ�������������ԭ�����ᡣij��������ͼ��ʾ�Ĺ��������������
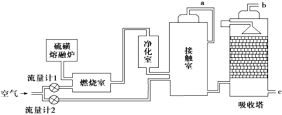
��ش��������⣺
��1��Ϊ������÷�Ӧ�ų����������Ӵ�����Ӧ��װ______________(���豸���ƣ��������������������ɹܣ���������_____________________________________________��
��2��Ϊʹ��dz��ȼ�գ���������1ͨ��ȼ���ҵ���������50%��Ϊ���SO2ת���ʣ���������2��������Ϊ�Ӵ����ж���������ȫ����ʱ������������2.5��������������������������1��������2�Ŀ��������ӦΪ________������Ӵ�����SO2��ת����Ϊ95%��b���ų���β���ж���������������Ϊ__________(���������������������0.2�ƣ�����β���Ĵ���������________��
��3������������Ϊԭ�ϵ�����������ȣ��ù��յ��ص���________(�ɶ�ѡ����
A������������ B�����������ת�������
C�������ķ������� D������Ҫʹ�ô���
��4���������;�dz��㣬��Ӧ����������Щ����__________________________��
A������ B��������Լ�������������ơ��ĺϳ�
C��Ǧ���ص����� D��������Ƶ��Ʊ�
��5������ȼ�ϵ�ȼ���Dz���������SO2����Ҫԭ��֮һ����ȼú�м���������ʯ��ʯ������Ч����úȼ��ʱSO2���ŷţ���д������������з�Ӧ�Ļ�ѧ����ʽ_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʳ���к���һ������þ���������ʣ��ӵ����е����ʧ��Ҫ���������ʡ�ˮ�֡������е������Լ����ա����ȶ����������֪��
�����ԣ�IO3����Fe3+��I2����ԭ�ԣ�S2O32����I����3I2+6OH���TIO3��+5I��+3H2O��KI+I2![]() KI3
KI3
ijѧϰС��Լӵ��ν�������ʵ�飺ȡһ����ij�ӵ��Σ����ܺ���KIO3��KI��Mg2+��Fe3+��������������ˮ�ܽ⣬����ϡ�����ữ����������Һ��Ϊ3�ݣ���һ����Һ�еμ�KSCN��Һ���Ժ�ɫ���ڶ�����Һ�м�����KI���壬��Һ�Ե���ɫ����CCl4��ȡ���²���Һ���Ϻ�ɫ����������Һ�м�������KIO3����μӵ����Լ�����Һ����ɫ��
��1������һ����Һ�еμ�KSCN��Һ�Ժ�ɫ���ú�ɫ������ ���û�ѧʽ��ʾ����
���ڶ�����Һ�м�������KI�����Ӧ�����ӷ���ʽΪ �� ��
��2����KI��Ϊ�ӵ����ʳ���ڱ�������У����ڿ��������������ã�������������ʧ��д����ʪ������KI��������Ӧ�Ļ�ѧ����ʽ�� ��
����I2����KI��Һ���ڵ��������£����Ƶ�KI3H2O����������Ϊʳ�μӵ���Ƿ���ʣ� ����ǡ�������˵������ ��
��3������6mol KI��������Һ����μ���KBrO3��Һ�����������к������ʵ����ʵ���������KBrO3�����ʵ����Ĺ�ϵ��ͼ��ʾ����ش��������⣺
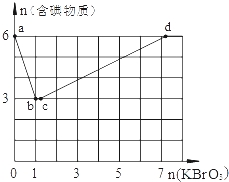
����֪b��ʱ��KI��Ӧ��ȫ��ת�Ƶĵ�����Ϊ ��
��b��c�����У�����һ��Ԫ�صĻ��ϼ۷����˱仯����Ӧʱ�������뻹ԭ�������ʵ���֮��Ϊ ��
��d��ʱ��n��KBrO3��Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������أ�K2FeO4����һ�ּ�������������������һ������Ͷ��ˮ���������������������£�
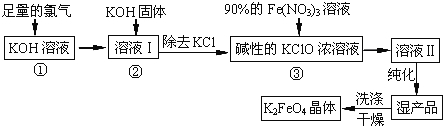
��1����Ӧ��Ӧ���¶Ƚϵ͵�����½��У������¶Ƚϸ�ʱKOH ��Cl2 ��Ӧ���ɵ���KClO3��д�����¶Ƚϸ�ʱKOH ��Cl2��Ӧ�Ļ�ѧ����ʽ ��
��2���ڷ�ӦҺI�м���KOH�����Ŀ���� �����ţ���
A���뷴ӦҺI�й�����Cl2������Ӧ�����ɸ����KClO
B��KOH�����ܽ�ʱ��ų��϶����������������߷�Ӧ����
C��Ϊ��һ����Ӧ�ṩ���ԵĻ���
D��ʹKClO3ת��Ϊ KClO
��3������ҺII�з����K2FeO4�����и���ƷKNO3��KCl����Ӧ���з��������ӷ�Ӧ����ʽΪ ��
��4������ж�K2FeO4�����Ѿ�ϴ�Ӹɾ� ��
��5��������أ�K2FeO4����Ϊˮ��������һ���ŵ�������ˮ��Ӧ���ɽ����������ʣ������ӷ�Ӧ�ǣ� FeO42��+ H2O= Fe(OH)3�����壩+ O2��+
��ɲ���ƽ������Ӧ�����ӷ���ʽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�о���ѧϰС������ͼװ�ý���SO2��FeCl3��Һ��Ӧ�����ʵ��(�г�װ������ȥ)��
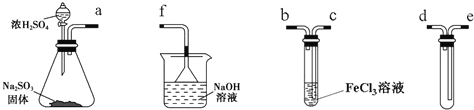
��1����װ����������������ȷ������˳����a��______��______��______��______��______��
��2���ձ��е���©����������_______________________��
��3����FeCl3��Һ��ͨ������SO2ʱ���۲쵽������Ϊ__________________��
��4��������������С��ͬѧ��ΪSO2��FeCl3��Һ������������ԭ��Ӧ��
��д��SO2��FeCl3��Һ��Ӧ�����ӷ���ʽ__________________��
����С��ͬѧ��ʢװFeCl3�Թܷ�Ӧ�����Һ�м��������ữ��BaCl2��Һ�������ְ�ɫ����������֤����Ӧ������SO42-����������������������__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ɻ�������Ƶ�1��4-�����������������£����������ﶼ����ȥ�����Իش�

��1����Ӧ_________����ȡ����Ӧ���Ӧ��ţ���
��2��������Ľṹ��ʽ��B______________��C_______________.
��3����Ӧ�������Լ���������________________________.
��4��д����Ӧ�������Ļ�ѧ����ʽ����Ӧ��________________��Ӧ��__________________.
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������泥�NH2COONH4,��Ƽ�泥���CO2��NH3�����ص��м�������CO2��Ӧ���ɼ�淋������仯����ͼ��ʾ��
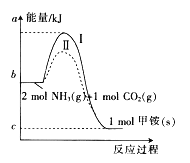
��1��ͼ�з�ӦΪ���淴Ӧ�������ɼ�淋ķ�Ӧ�� ��������������������������Ӧ��
��2���ϳɼ�淋��Ȼ�ѧ����ʽΪ ��
��3������ͬһ��Ӧ��ͼ�����ߣ�������ʵ�ߣ�������ȣ���ܴ�ͣ���ԭ���� ��
��4����֪�ɼ�狀ϳ����صķ�ӦΪNH2COONH4��s��![]()
![]() ��
��![]() ������CO2(g)��NH3��g��ֱ�Ӻϳɹ�̬���ز�����Һ̬ˮ���Ȼ�ѧ����ʽΪ ��
������CO2(g)��NH3��g��ֱ�Ӻϳɹ�̬���ز�����Һ̬ˮ���Ȼ�ѧ����ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�������̿�(MnCO3)�ۺ�FeCO3��SiO2��Cu2(OH) 2CO3�����ʣ�Ϊԭ����ȡ�������̣�������ʾ��ͼ���£�
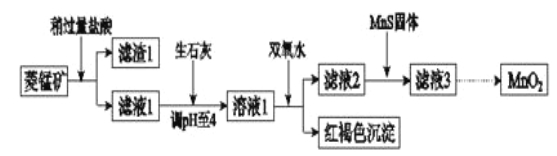
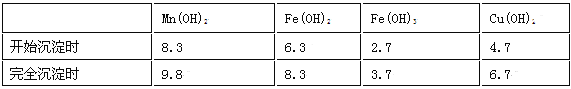
��֪�������������������pH
ע���������ӵ���ʼŨ��Ϊ0.1 mol/L,�ش��������⣺
��1�������ʵ����̿�ʹ��ǰ�轫����飬��ҪĿ���� _______ ___________ �������ܽ�MnCO3�Ļ�ѧ����ʽ��_______ ______________ ___ _____��
��2������Һ1�м���˫��ˮʱ����Ӧ�����ӷ���ʽ�� _______ ___________ ��
��3����Һ2�м����Թ��������ܵ����MnS���Գ�ȥCu2+����Ӧ�����ӷ���ʽ�� ________ ��
��4����MnCl2ת��ΪMnO2��һ�ַ���������������������������ữ��NaClO3��Һ��MnCl2�������÷�Ӧ�����ӷ���ʽΪ����Mn2������ClO3������________����________����________����________��
��5����MnCl2ת��ΪMnO2����һ�ַ����ǵ�ⷨ��
�� ��������MnO2�ĵ缫��Ӧʽ�� ____ ___ ____________ _______ ��
����ֱ�ӵ��MnCl2��Һ������MnO2��ͬʱ���������Cl2������Cl2�IJ����� _____ ��
����������MnCl2��Һ�м���һ������Mn(NO3)2��ĩ������Cl2��������ԭ���� ___ __ ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com