
【题目】某研究性学习小组用下图装置进行SO2与FeCl3溶液反应的相关实验(夹持装置已略去)。
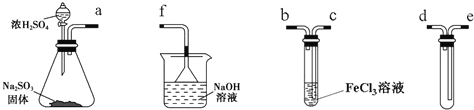
(1)组装仪器按气流方向正确的连接顺序是a接______、______接______、______接______;
(2)烧杯中倒置漏斗的作用是_______________________;
(3)往FeCl3溶液中通入足量SO2时,观察到的现象为__________________;
(4)根据以上现象,该小组同学认为SO2与FeCl3溶液发生了氧化还原反应.
①写出SO2与FeCl3溶液反应的离子方程式__________________;
②该小组同学向盛装FeCl3试管反应后的溶液中加入硝酸酸化的BaCl2溶液,若出现白色沉淀,即可证明反应生成了SO42-.该做法不合理,理由是__________________。
【答案】(1)d e c b f (2)使气体充分吸收,防止溶液倒吸 (3)溶液由棕黄色变为浅绿色 (4)①2Fe3++SO2+2H2O=SO42-+4H++2Fe2+ ②硝酸可以将溶解的SO2氧化为H2SO4,干扰试验
【解析】
试题分析:(1)根据实验目的,先是制备二氧化硫,用第一个装置,用最后一个装置,导管要短进长出,可以防止倒吸,然后是让二氧化硫和氯化铁之间反应,即第三个装置,最后进行尾气处理,顺序是:d、e、c、b、f;
(2)因尾气易溶于NaOH溶液,则倒置漏斗的作用为防止NaOH溶液倒吸;
(3)通入足量SO2时C中发生二氧化硫与氯化铁的氧化还原反应,生成硫酸亚铁,则观察到溶液由棕黄色变为浅绿色;
(4)①发生氧化还原反应,生成硫酸根离子、亚铁离子,离子反应为2Fe3++SO2+2H2O=SO42-+4H++2Fe2+;②该小组同学向C试管反应后的溶液中加入硝酸酸化的BaCl2溶液,硝酸具有强氧化性,则硝酸可以将溶解的SO2氧化为 H2SO4,干扰试验,故做法不合理。


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:
【题目】某二元酸(化学式用H2B表示)在水中的电离方程式是:H2B═H++HB-;HB-![]() H++B2-,回答下列问题:
H++B2-,回答下列问题:
(1)NaHB溶液显___________(填“酸性”、“中性”或“碱性”或“酸碱性无法确定”),理由是___________。
(2)某温度下,向0.1mol/L的NaHB溶液中滴入0.1mol/LKOH溶液至中性,此时溶液中以下关系一定正确的是___________(填字母).
A.c(H+)c(OH-)═1×10-14 mol2/L2
B.c(Na+)+c(K+)═c(HB-)+2c(A2-)
C.c(Na+)>c(K+)
D.c(Na+)+c(K+)═0.05mol/L
(3)已知常温下H2B的钙盐(CaB)饱和溶液中存在以下平衡:CaB(s) ![]() Ca2+(aq)+B2-(aq)△H>0.
Ca2+(aq)+B2-(aq)△H>0.
①温度升高时,Ksp ___________(填“增大”、“减小”或“不变”,下同)。
②滴加少量浓盐酸,c(Ca2+)___________,原因是___________(用文字和离子方程式说明)。
(4) 已知0.1molL-1NaHB溶液的pH=2,则0.1molL-1H2B溶液中氢离子的物质的量浓度可能是___________0.11molL-1(填“<”、“>”、或“=”); 理由是___________。
(5)0.1 mol/L NaHB溶液中各种离子浓度由大到小的顺序是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列装置中,MSO4和NSO4是两种常见金属的易溶盐。当K闭合时,SO从右到左通过交换膜移向M极,下列分析正确的是( )
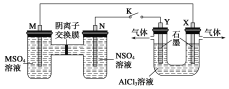
A.溶液中c(M2+)减小
B.N的电极反应式:N-2e-===N2+
C.X电极上有H2产生,发生还原反应
D.反应过程中Y电极周围生成白色胶状沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A是一种重要的基本化工原料,其分子中碳元素的百分含量为85.7%,且相对分子量小于30。A、B、C、D、E、F、G、H有下图所示的转化关系(部分产物已略去)。其中B为高分子化合物,C为无色无味气体,实验室中可以通过G与大理石制取。D为烃,不能使酸性高锰酸钾溶液褪色。E、G为生活中常见的有机物,且E有特殊香味,H有香味。
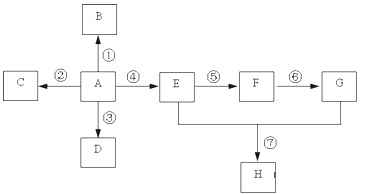
(1)写出下列各物质的官能团的名称:A ___________;E ___________;
(2)按要求写出下列各步变化的化学方程式(注明反应条件)
反应①_____________________________________________________;
反应④_____________________________________________________;
反应⑦ _____________________________________________________。
(3)写出下列反应类型:反应① ___________,反应②___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:2NO2![]() 2NO+O2 在恒容密闭容器中反应,达到平衡状态的标志是( )
2NO+O2 在恒容密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成n molO2的同时生成2n molNO2;
②单位时间内生成n molO2 的同时生成2n mol NO;
③用NO2、NO、O2 的物质的量浓度变化表示的反应速率的比为2:2:1的状态;
④混合气体中![]() 不变;
不变;
⑤混合气体的颜色不再改变的状态;
⑥混合气体的密度不再改变的状态;
⑦混合气体的平均相对分子质量不再改变的状态.
A.①⑤⑥ B.①④⑤⑦ C.①⑤⑥⑦ D.①③⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物 (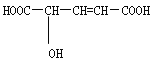 ),常用于汽水、糖果的添加剂。
),常用于汽水、糖果的添加剂。
(1)分子中官能团的名称是
(2)写出与Na反应的化学方程式:
(3)写出与NaHCO3反应的化学方程式:
(4)写出与乙醇完全酯化反应的化学方程式:
(5)请选择适当试剂,检验该有机物分子中含有醇羟基,并写出实验方法和现象:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.乙烯是是由裂解气的主要成分,它的产量通常用来衡量一个国家的石油化工水平。
下图是石蜡油在炽热碎瓷片的作用下产生乙烯并检验其性质的实验,完成下列问题。
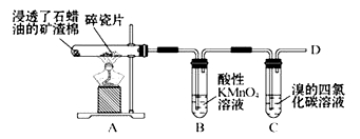
(1)A中碎瓷片的作用是 。
(2)B中反应类型是 。C中实验现象是 。
II.现有CH4、C2H4、C6H6三种有机化合物:
(3)等质量的以上物质完全燃烧时耗去O2的量最多的是__________。生成二氧化碳最多的是__________,生成水最多的是_________。
III.(4)分子式为C9H12的苯的同系物有 种,若在苯环上发生硝化反应时,生成的一硝基取代物只有一种,该烃的结构简式为 。
(5)分子中含有22 个共价键的烷烃,烷烃的分子式: 。
(6)支链只有一个乙基且式量最小的烷烃的结构简式 ,其名称为 。
(7)将某种烷烃进行氯代反应,测出一氯代物有4 种。3.6g 该烃完全生成一氯代物时,放出的气体用蒸馏水完全吸收,所得溶液用0.1 mol·L-1NaOH 溶液500mL恰好中和。则此烷烃的分子式为 ,其结构简式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.如图是实验室制乙烯的发生装置和乙烯性质实验装置,反应原理为:CH3CH2OH![]() CH2===CH2↑+H2O,回答下列问题:
CH2===CH2↑+H2O,回答下列问题:
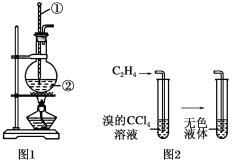
(1)图1中仪器①、②的名称分别为________、________。
(2)收集乙烯气体最好的方法是________。
(3)向溴的四氯化碳溶液中通入乙烯(如图2),溶液的颜色很快褪去,该反应属于____(填反应类型),反应的化学方程式为_______。
Ⅱ.实验室制取乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫。有人设计下列实验以确认上述混合气体中有乙烯和二氧化硫。试回答下列问题:
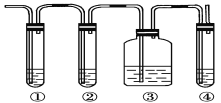
(1)图中①、②、③、④装置盛放的试剂是下列中的(将正确选项填入空格内):
①__________;②__________;③__________;④__________。
A.品红溶液 B.氢氧化钠溶液
C.浓硫酸 D.酸性高锰酸钾溶液
(2)能说明二氧化硫气体存在的现象是____________________。
(3)使用装置②的目的是________________________________。
(4)使用装置③的目的是_______________________________。
(5)验证含有乙烯的现象是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2。某同学在实验室中对NH3与NOx反应进行了探究。回答下列问题:
(1)氨气的制备

①氨气的发生装置可以选择上图中的_________,反应的化学方程式为_______________。
②欲收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:发生装置→______(按气流方向,用小写字母表示)。
(2)氨气与二氧化氮的反应
将上述收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好)。在一定温度下按图示装置进行实验。

操作步骤 | 实验现象 | 解释原因 |
打开K1,推动注射器活塞,使X中的气体缓慢通入Y管中 | ①Y管中_____________ | ②反应的化学方程式 ____________ |
将注射器活塞退回原处并固定,待装置恢复到室温 | Y管中有少量水珠 | 生成的气态水凝集 |
打开K2 | ③_______________ | ④______________ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com