
【题目】有机物 (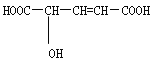 ),常用于汽水、糖果的添加剂。
),常用于汽水、糖果的添加剂。
(1)分子中官能团的名称是
(2)写出与Na反应的化学方程式:
(3)写出与NaHCO3反应的化学方程式:
(4)写出与乙醇完全酯化反应的化学方程式:
(5)请选择适当试剂,检验该有机物分子中含有醇羟基,并写出实验方法和现象:
【答案】(1)羧基 碳碳双键, 羟基
![]()
![]() (2)
(2)![]()
(3)HOOCCH(OH) CH=CH COOH + 2NaHCO3→NaOOCCH(OH) CH=CH COONa + 2CO2↑ + 2H2O
(4)HOOCCH(OH)CH=CHCOOH+2CH3CH2OH→CH3CH2OOCCH(OH)CH=CHCOOCH2CH3+2H2O
(5)取少量该有机物加入适当溴水,使碳碳双键完全反应,再加入少量酸性高锰酸钾溶液,溶液褪色则说明含有醇羟基
【解析】
试题分析:(1)根据有机物的结构简式可知,该有机物含有羟基、羧基、碳碳双键三种官能团。
故答案为:羟基;羧基;碳碳双键;
(2)该有机物与Na反应的化学方程式为:2HOOCCH(OH)CH=CHCOOH+6Na→3H2↑+2NaOOCCH(ONa)CH=CHCOONa。
故答案为:2HOOCCH(OH)CH=CHCOOH+6Na→3H2↑+2NaOOCCH(ONa)CH=CHCOONa;
(3)由于酸性-COOH>碳酸>醇,所以该有机物与反应的化学方程式为:HOOCCH(OH)CH=CHCOOH+ 2NaHCO3→NaOOCCH(OH)CH=CHCOONa+2CO2↑+2H2O。
故答案为:HOOCCH(OH)CH=CHCOOH+ 2NaHCO3→NaOOCCH(OH)CH=CHCOONa+2CO2↑+2H2O;
(4)该有机物分子中含有2个-COOH,与乙醇完全酯化反应的化学方程式为:HOOCCH(OH)CH=CHCOOH+2CH3CH2OH→CH3CH2OOCCH(OH)CH=CHCOOCH2CH3+2H2O。
故答案为:HOOCCH(OH)CH=CHCOOH+2CH3CH2OH→CH3CH2OOCCH(OH)CH=CHCOOCH2CH3+2H2O;
(5)检验该有机物分子中含有醇羟基可以选择酸性高锰酸钾溶液,但由于碳碳双键也能够使酸性高锰酸钾溶液褪色,应首先用溴水消除碳碳双键。所以具体实验方法和现象为:取少量该有机物加入适当溴水,使碳碳双键完全反应,再加入少量酸性高锰酸钾溶液,溶液褪色则说明含有醇羟基。
故答案为:取少量该有机物加入适当溴水,使碳碳双键完全反应,再加入少量酸性高锰酸钾溶液,溶液褪色则说明含有醇羟基。


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】四苯基乙烯(TPE)及其衍生物具有聚集诱导发光特性,在光电材料等领域应用前景广阔。以下是TPE的两条合成路线(部分试剂和反应条件省略):
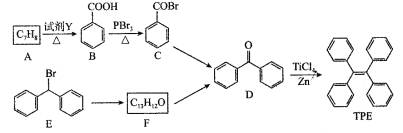
(1)A的名称是___________。
(2)B![]() C的反应类型是____________; D中官能团的名称是_____________。
C的反应类型是____________; D中官能团的名称是_____________。
(3)E![]() F的化学方程式是____________。
F的化学方程式是____________。
(4)W是D的同分异构体,具有下列结构特征:①属于萘(![]() )的一元取代物;②存在羟甲基(—CH2OH)。写出W所有可能的结构简式_____________。
)的一元取代物;②存在羟甲基(—CH2OH)。写出W所有可能的结构简式_____________。
(5)下列说法正确的是__________
a.B的酸性比苯酚强
b.D不能发生还原反应
c.E含有3种不同化学环境的氢
d.TPE既属于芳香烃也属于烯烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以电石渣[主要成分为Ca(OH)2和CaCO3]为原料制备KClO3的流程如下:
![]()
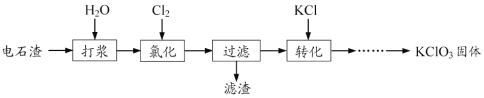
(1)氯化过程控制电石渣过量,在75℃左右进行。氯化时存在Cl2与Ca(OH)2作用生成Ca(ClO)2的反应,Ca(ClO)2进一步转化为Ca(ClO3)2,少量Ca(ClO)2 分解为CaCl2和O2。
①生成Ca(ClO)2的化学方程式为 。
②提高Cl2转化为Ca(ClO3)2的转化率的可行措施有 (填序号)。
A.适当减缓通入Cl2速率
B.充分搅拌浆料
C.加水使Ca(OH)2完全溶解
(2)氯化过程中Cl2 转化为Ca(ClO3)2的总反应方程式为
6Ca(OH)2+6Cl2===Ca(ClO3)2+5CaCl2+6H2O
氯化完成后过滤。
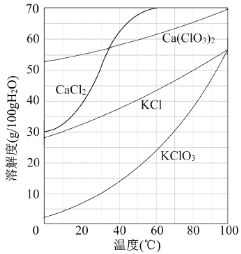
①滤渣的主要成分为 (填化学式)。
②滤液中Ca(ClO3)2与CaCl2的物质的量之比n[Ca(ClO3)2] ∶n[CaCl2] 1∶5(填“>”、“<”或“=”)。
(3)向滤液中加入稍过量KCl固体可将Ca(ClO3)2转化为KClO3,若溶液中KClO3的含量为100gL-1,从该溶液中尽可能多地析出KClO3固体的方法是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:NO3-+4H++3e-═NO↑+2H2O,KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)写出该氧化还原反应的化学方程式__________________________________;
(2)反应中硝酸体现了__________、______;
(3)反应中若产生标准状况下11.2L气体,则转移电子的物质的量是__________;
(4)现称取含有杂质的甲样品(杂质与酸不反应)5.4g,恰好与100mL 1.4mol/L的硝酸溶液完全反应,则该样品的纯度为__________;
(5)若1mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组用下图装置进行SO2与FeCl3溶液反应的相关实验(夹持装置已略去)。
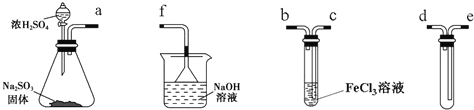
(1)组装仪器按气流方向正确的连接顺序是a接______、______接______、______接______;
(2)烧杯中倒置漏斗的作用是_______________________;
(3)往FeCl3溶液中通入足量SO2时,观察到的现象为__________________;
(4)根据以上现象,该小组同学认为SO2与FeCl3溶液发生了氧化还原反应.
①写出SO2与FeCl3溶液反应的离子方程式__________________;
②该小组同学向盛装FeCl3试管反应后的溶液中加入硝酸酸化的BaCl2溶液,若出现白色沉淀,即可证明反应生成了SO42-.该做法不合理,理由是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,淀粉水解可产生某有机化合物A,A在不同的氧化剂作用下可以生成B(C6H12O7)或C(C6H10O8),B和C都不能发生银镜反应。A、B、C都可以被强还原剂还原成为D(C6H14O6)。已知,相关物质被氧化的难易次序是:RCHO最易,R—CH2OH次之,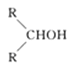 最难。
最难。
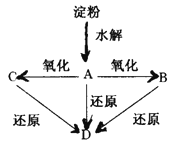
请回答下列问题:
(1)请在下列横线上填写A、B、C、D的结构简式。
A: ;B: ;C: ;D: 。
(2)写出下列反应的化学方程式。
淀粉→A:
A→D:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2与Cl2的氧化性相近,在自来水消毒和果蔬保鲜等方面应用广泛。某兴趣小组通过如图1装置(夹持装置略)对其制备、吸收、释放和应用进行了研究。
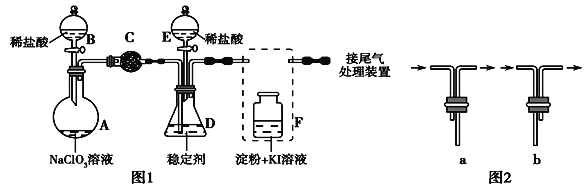
(1)仪器A的名称是________________。安装F中导管时,应选用图2中的_________。
(2)打开B的活塞,A中发生反应:2NaClO3+4HCl===2ClO2↑+Cl2↑+2NaCl+2H2O,为使ClO2在D中被稳定剂充分吸收,滴加稀盐酸的速度宜__________(填“快”或“慢”)。
(3)关闭B的活塞,ClO2在D中被稳定剂完全吸收生成NaClO2,此时F中溶液的颜色不变,则装置C的作用是________________________________。
(4)已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为_________________________。在ClO2释放实验中,打开E的活塞,D中发生反应,则装置F的作用是_________________________________。
(5)已吸收ClO2气体的稳定剂Ⅰ和稳定剂Ⅱ,加酸后释放ClO2的浓度随时间的变化如图所示。若将其用于水果保鲜,你认为效果较好的稳定剂是_____________,
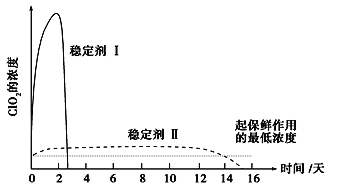
理由:_____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肉桂酸异戊酯G(![]() )是一种香料,一种合成路线如下:
)是一种香料,一种合成路线如下:
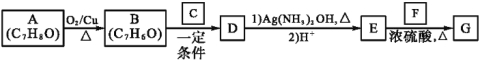
已知以下信息:
①RCHO+R'CH2CHO![]()
![]() ;
;
②C为甲醛的同系物,相同条件下其蒸气与氢气的密度比为22。
回答下列问题:
(1)A的化学名称为 。
(2)B和C反应生成D的化学方程式为 。
(3)F中含有官能团的名称为 。
(4)E和F反应生成G的化学方程式为 ,反应类型为 。
(5)F的同分异构体中不能与金属钠反应生成氢气的共有 种(不考虑立体异构),其中核磁共振氢谱只有两组峰,且峰面积比为3∶1的为 (写结构简式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修2:化学与技术]高锰酸钾(KMnO4)是一种常用氧化剂,主要用于化工、防腐及制药工业等。以软锰矿(主要成分为MnO2)为原料生产高锰酸钾的工艺路线如下:

回答下列问题:
(1)原料软锰矿与氢氧化钾按1∶1的比例在“烘炒锅”中混配,混配前应将软锰矿粉碎,其作用是 。
(2)“平炉”中发生的化学方程式为 。
(3)“平炉”中需要加压,其目的是 。
(4)将K2MnO4转化为KMnO4的生产有两种工艺。
①“![]() 歧化法”是传统工艺,即在K2MnO4溶液中通入CO2气体,使体系呈中性或弱酸性,K2MnO4发生歧化反应,反应中生成K2MnO4、MnO2和 (写化学式)。
歧化法”是传统工艺,即在K2MnO4溶液中通入CO2气体,使体系呈中性或弱酸性,K2MnO4发生歧化反应,反应中生成K2MnO4、MnO2和 (写化学式)。
②“电解法”为现代工艺,即电解K2MnO4水溶液,电解槽中阳极发生的电极反应为 ,阴极逸出的气体是 。
③“电解法”和“![]() 歧化法”中,K2MnO4的理论利用率之比为 。
歧化法”中,K2MnO4的理论利用率之比为 。
(5)高锰酸钾纯度的测定:称取1.0800 g样品,溶解后定容于100 mL容量瓶中,摇匀。取浓度为0.2000 mol·L1的H2C2O4标准溶液20.00 mL,加入稀硫酸酸化,用KMnO4溶液平行滴定三次,平均消耗的体积为24.48 mL,该样品的纯度为 (列出计算式即可,已知2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com