
【题目】已知A是一种重要的基本化工原料,其分子中碳元素的百分含量为85.7%,且相对分子量小于30。A、B、C、D、E、F、G、H有下图所示的转化关系(部分产物已略去)。其中B为高分子化合物,C为无色无味气体,实验室中可以通过G与大理石制取。D为烃,不能使酸性高锰酸钾溶液褪色。E、G为生活中常见的有机物,且E有特殊香味,H有香味。
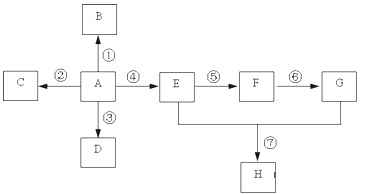
(1)写出下列各物质的官能团的名称:A ___________;E ___________;
(2)按要求写出下列各步变化的化学方程式(注明反应条件)
反应①_____________________________________________________;
反应④_____________________________________________________;
反应⑦ _____________________________________________________。
(3)写出下列反应类型:反应① ___________,反应②___________。
【答案】(12)(1)碳碳双键;羟基
(2)![]() ;CH2=CH2+H2O
;CH2=CH2+H2O![]() CH3CH2OH;
CH3CH2OH;
CH3CH2OH+CH3COOH![]() CH3CH2OOCCH3+H2O
CH3CH2OOCCH3+H2O
(3)加聚反应;氧化反应
【解析】
试题分析:已知A是一种重要的基本化工原料,其分子中碳元素的百分含量为85.7%,且相对分子量小于30。设A的分子式为CxHy,则x=![]() ,则A的相对分子质量M(A)=
,则A的相对分子质量M(A)=![]() ,y=
,y=![]() 。所以A的分子式为C2H4,A为乙烯,结构简式为:CH2=CH2,官能团为碳碳双键。
。所以A的分子式为C2H4,A为乙烯,结构简式为:CH2=CH2,官能团为碳碳双键。
根据转化关系可知,乙烯发生加聚反应生成高分子化合物B,则B为聚乙烯;C为无色无味气体,实验室中可以通过G与大理石制取,则C为CO2气体,反应②为乙烯的燃烧反应,也是氧化反应;D为烃,不能使酸性高锰酸钾溶液褪色,则D为乙烯与氢气发生加成反应生成物乙烷;E、G为生活中常见的有机物,且E有特殊香味,H有香味,则E为乙烯与H2O的发生加成反应的产物乙醇;乙醇催化氧化生成乙醛,F为乙醛;乙醛进一步催化氧化生成乙酸,G为乙酸;乙酸和乙醇在浓硫酸、加热条件下发生酯化反应生成乙酸乙酯H。据此可得下列结论:
(1)A为乙烯,结构简式为:CH2=CH2,官能团为碳碳双键;E为乙醇,官能团为羟基。
故答案为:碳碳双键;羟基;
(2)反应①为乙烯的加聚反应,化学方程式为:![]() 。
。
故答案为:![]() ;
;
反应④为乙烯和水的加成反应,化学方程式为:CH2=CH2+H2O![]() CH3CH2OH。
CH3CH2OH。
故答案为:CH2=CH2+H2O![]() CH3CH2OH;
CH3CH2OH;
反应⑦为乙酸和乙醇在浓硫酸、加热条件下发生酯化反应生成乙酸乙酯,化学方程式为:CH3CH2OH+CH3COOH![]() CH3CH2OOCCH3+H2O。
CH3CH2OOCCH3+H2O。
故答案为:CH3CH2OH+CH3COOH![]() CH3CH2OOCCH3+H2O;
CH3CH2OOCCH3+H2O;
(3)反应①的反应类型为加聚反应;反应②的反应类型为氧化反应。
故答案为:加聚反应;氧化反应。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,所列字母分别代表一种元素:
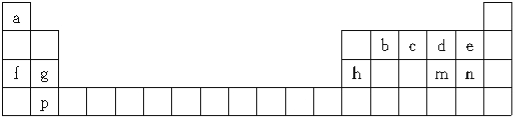
(1)m元素在周期表中的位置是 。
(2)下列有关说法正确的是 (填字母)。
A.b、c、d元素的非金属性逐渐增大 |
B.f、g、h元素的原子半径逐渐减小 |
C.md2与bd2的化学性质类似,都具有氧化性 |
D.e、n的最高价含氧酸的酸性强弱:e>n |
E.a、f分别与d组成的化合物中所含化学键类型完全相同
F.该表中只有4种元素组成的单质具有导电性
(3)a、c、n按原子个数比为4:1:1构成的化合物是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某汽车安全气囊的产气药剂主要含有NaN3、Fe2O3、KClO4、NaHCO3等物质。当汽车发生碰撞时,产气药剂产生大量气体使气囊迅速膨胀,从而起到保护作用。
(1)NaN3是气体发生剂,受热分解产生N2和Na,N2的电子式为________。
(2)Fe2O3是主氧化剂,与Na发生置换反应生成的还原产物为________。
(3)KClO4是助氧化剂,反应过程中与Na作用生成KCl和Na2O。KClO4含有化学键的类型为________,金属晶体K的堆积方式为________。
(4)NaHCO3是冷却剂,吸收产气过程中释放的热量而发生分解,其化学方程式为______
__________________________________。
(5)100 g上述产气药剂产生的气体通过碱石灰后得到N2 33.6 L(标准状况)。
①用碱石灰除去的物质为________________;
②该产气药剂中NaN3的质量分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以电石渣[主要成分为Ca(OH)2和CaCO3]为原料制备KClO3的流程如下:
![]()
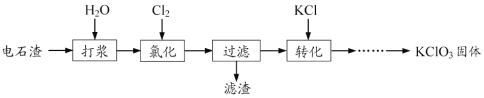
(1)氯化过程控制电石渣过量,在75℃左右进行。氯化时存在Cl2与Ca(OH)2作用生成Ca(ClO)2的反应,Ca(ClO)2进一步转化为Ca(ClO3)2,少量Ca(ClO)2 分解为CaCl2和O2。
①生成Ca(ClO)2的化学方程式为 。
②提高Cl2转化为Ca(ClO3)2的转化率的可行措施有 (填序号)。
A.适当减缓通入Cl2速率
B.充分搅拌浆料
C.加水使Ca(OH)2完全溶解
(2)氯化过程中Cl2 转化为Ca(ClO3)2的总反应方程式为
6Ca(OH)2+6Cl2===Ca(ClO3)2+5CaCl2+6H2O
氯化完成后过滤。
①滤渣的主要成分为 (填化学式)。
②滤液中Ca(ClO3)2与CaCl2的物质的量之比n[Ca(ClO3)2] ∶n[CaCl2] 1∶5(填“>”、“<”或“=”)。
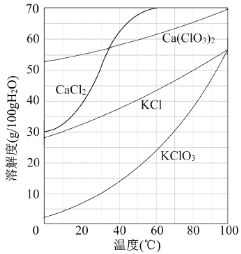
(3)向滤液中加入稍过量KCl固体可将Ca(ClO3)2转化为KClO3,若溶液中KClO3的含量为100gL-1,从该溶液中尽可能多地析出KClO3固体的方法是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食盐中含有一定量的镁、铁等杂质,加碘盐中碘的损失主要是由于杂质、水分、空气中的氧气以及光照、受热而引起的。已知:
氧化性:IO3﹣>Fe3+>I2;还原性:S2O32﹣>I﹣;3I2+6OH﹣═IO3﹣+5I﹣+3H2O;KI+I2![]() KI3
KI3
某学习小组对加碘盐进行如下实验:取一定量某加碘盐(可能含有KIO3、KI、Mg2+、Fe3+),用适量蒸馏水溶解,并加稀盐酸酸化,将所得溶液分为3份.第一份试液中滴加KSCN溶液后显红色;第二份试液中加足量KI固体,溶液显淡黄色,用CCl4萃取,下层溶液显紫红色;第三份试液中加入适量KIO3固体后,滴加淀粉试剂,溶液不变色。
(1)①第一份试液中滴加KSCN溶液显红色,该红色物质是 (用化学式表示);
②第二份试液中加入足量KI固体后,反应的离子方程式为 、 。
(2)①KI作为加碘剂的食盐在保存过程中,由于空气中氧气的作用,容易引起碘的损失。写出潮湿环境下KI与氧气反应的化学方程式: 。
②将I2溶于KI溶液,在低温条件下,可制得KI3H2O。该物质作为食盐加碘剂是否合适? (填“是”或“否”),并说明理由 。
(3)现向含6mol KI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加KBrO3的物质的量的关系如图所示。请回答下列问题:
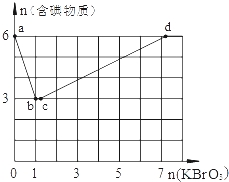
①已知b点时,KI反应完全,转移的电子数为 。
②b→c过程中,仅有一种元素的化合价发生了变化.则反应时氧化剂与还原剂的物质的量之比为 。
③d点时,n(KBrO3)为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:NO3-+4H++3e-═NO↑+2H2O,KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)写出该氧化还原反应的化学方程式__________________________________;
(2)反应中硝酸体现了__________、______;
(3)反应中若产生标准状况下11.2L气体,则转移电子的物质的量是__________;
(4)现称取含有杂质的甲样品(杂质与酸不反应)5.4g,恰好与100mL 1.4mol/L的硝酸溶液完全反应,则该样品的纯度为__________;
(5)若1mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组用下图装置进行SO2与FeCl3溶液反应的相关实验(夹持装置已略去)。
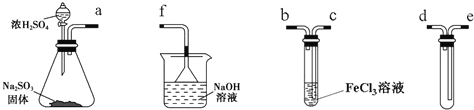
(1)组装仪器按气流方向正确的连接顺序是a接______、______接______、______接______;
(2)烧杯中倒置漏斗的作用是_______________________;
(3)往FeCl3溶液中通入足量SO2时,观察到的现象为__________________;
(4)根据以上现象,该小组同学认为SO2与FeCl3溶液发生了氧化还原反应.
①写出SO2与FeCl3溶液反应的离子方程式__________________;
②该小组同学向盛装FeCl3试管反应后的溶液中加入硝酸酸化的BaCl2溶液,若出现白色沉淀,即可证明反应生成了SO42-.该做法不合理,理由是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2与Cl2的氧化性相近,在自来水消毒和果蔬保鲜等方面应用广泛。某兴趣小组通过如图1装置(夹持装置略)对其制备、吸收、释放和应用进行了研究。
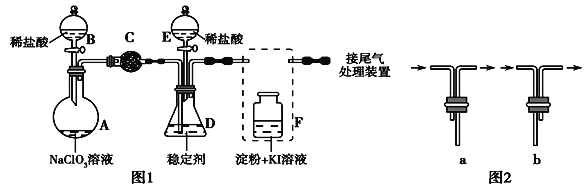
(1)仪器A的名称是________________。安装F中导管时,应选用图2中的_________。
(2)打开B的活塞,A中发生反应:2NaClO3+4HCl===2ClO2↑+Cl2↑+2NaCl+2H2O,为使ClO2在D中被稳定剂充分吸收,滴加稀盐酸的速度宜__________(填“快”或“慢”)。
(3)关闭B的活塞,ClO2在D中被稳定剂完全吸收生成NaClO2,此时F中溶液的颜色不变,则装置C的作用是________________________________。
(4)已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为_________________________。在ClO2释放实验中,打开E的活塞,D中发生反应,则装置F的作用是_________________________________。
(5)已吸收ClO2气体的稳定剂Ⅰ和稳定剂Ⅱ,加酸后释放ClO2的浓度随时间的变化如图所示。若将其用于水果保鲜,你认为效果较好的稳定剂是_____________,
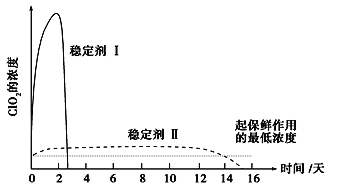
理由:_____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋资源的利用具有广阔前景.
(1)如图是从海水中提取镁的简单流程.
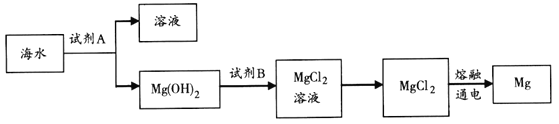
①工业上常用于沉淀Mg2+的试剂A是________,Mg(OH)2转化为MgCl2的离子方程式是_______.
②由无水MgCl2制取Mg的化学方程式是________.
(2)海带灰中富含以I﹣形式存在的碘元素.实验室提取I2的途径如下所示:
![]()
①灼烧海带至灰烬时所用的主要仪器名称是________.
②向酸化的滤液中加过氧化氢溶液,写出该反应的离子方程式________.
③反应结束后,加入CCl4作萃取剂,采用萃取﹣分液的方法从碘水中提取碘,主要操作步骤如图:
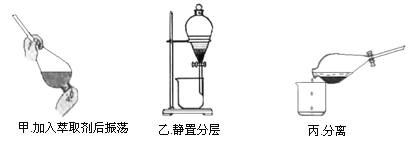
甲、乙、丙3步实验操作中,不正确的是________(填“甲”、“乙”或“丙”).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com