
【题目】某汽车安全气囊的产气药剂主要含有NaN3、Fe2O3、KClO4、NaHCO3等物质。当汽车发生碰撞时,产气药剂产生大量气体使气囊迅速膨胀,从而起到保护作用。
(1)NaN3是气体发生剂,受热分解产生N2和Na,N2的电子式为________。
(2)Fe2O3是主氧化剂,与Na发生置换反应生成的还原产物为________。
(3)KClO4是助氧化剂,反应过程中与Na作用生成KCl和Na2O。KClO4含有化学键的类型为________,金属晶体K的堆积方式为________。
(4)NaHCO3是冷却剂,吸收产气过程中释放的热量而发生分解,其化学方程式为______
__________________________________。
(5)100 g上述产气药剂产生的气体通过碱石灰后得到N2 33.6 L(标准状况)。
①用碱石灰除去的物质为________________;
②该产气药剂中NaN3的质量分数为________。
【答案】(1) ![]()
(2)Fe
(3)离子键和共价键 体心立方堆积
(4)2NaHCO3![]() Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
(5)①CO2 、H2O ②65%
【解析】
试题分析:(1)由8电子结构可知,N2分子中N原子之间形成3对共用电子对,其电子式为![]() ,
,
故答案为:![]() ;
;
(2)Fe2O3是主氧化剂,与Na发生置换反应,Fe元素发生还原反应,则还原产物为Fe,
故答案为:Fe;
(3)KClO4由钾离子与高氯酸根离子构成,含有离子键;高氯酸根离子中Cl原子与O原子之间形成共价键;单质钾晶体属于体心立方堆积。
故答案为:离子键、共价键;体心立方堆积;
(4)碳酸氢钠分解生成碳酸钠、二氧化碳与水,该反应化学方程式为:2NaHCO3![]() Na2CO3+CO2↑+H2O。
Na2CO3+CO2↑+H2O。
故答案为:2NaHCO3![]() Na2CO3+CO2↑+H2O;
Na2CO3+CO2↑+H2O;
(5)①碱石灰可以吸收二氧化碳、水蒸汽,用碱石灰除去的物质为CO2、H2O。
故答案为:CO2、H2O;
②氮气的物质的量n(N2)= ![]() =1.5mol,根据氮元素守恒n(NaN3)=
=1.5mol,根据氮元素守恒n(NaN3)= ![]() =1mol,
=1mol,
则m(NaN3)=1mol×65g/mol=65g,故NaN3的质量分数为:![]() ×100%=65%。
×100%=65%。
故答案为:65。


 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案科目:高中化学 来源: 题型:
【题目】(1)下列各组粒子互为同位素的是 (填编号,下同)。互为同素异形体的是 ,互为同分异构体的是 互为同系物的是 。
①16O2和18O3
②质子数相同而中子数不同的两种粒子
③11H、D、T
④3015R和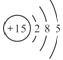 (核内15个中子)
(核内15个中子)
⑤葡萄糖和果糖
⑥
⑦CH3CH2CH2CH2CH2CH3和(CH3)2CHCH(CH3)2
⑧(CH3)2CHCH(CH3)2和C(CH3)4
(2)生活中的一些问题常涉及化学知识,下列叙述正确的是(填序号) 。
①淀粉、蛋白质都是天然有机高分子化合物
②食用植物油的重要成分是高级不饱和脂肪酸甘油酯,是人体的营养物质
③禁止使用含铅汽油是为了提高汽油的燃烧效率
④福尔马林是一种良好的杀毒剂,也可用来消毒自来水
⑤随着人们生活节奏的加快,方便的小包装食品已被广泛接受.为了防止中秋月饼等富脂食品氧化变质,延长食品的保质期,在包装袋中常放入生石灰
⑥向蛋白质溶液中加入(NH4)2SO4浓溶液,蛋白质会析出,加水后不再溶解
⑦为保证加酶洗衣粉的洗涤效果,应用沸水溶解洗衣粉
(3)在实验室生成乙酸乙酯的可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应的限度,也即达到化学平衡状态.下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有(填序号) .
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
④正反应的速率与逆反应的速率相等
⑤混合物中各物质的浓度不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某二元酸(化学式用H2B表示)在水中的电离方程式是:H2B═H++HB-;HB-![]() H++B2-,回答下列问题:
H++B2-,回答下列问题:
(1)NaHB溶液显___________(填“酸性”、“中性”或“碱性”或“酸碱性无法确定”),理由是___________。
(2)某温度下,向0.1mol/L的NaHB溶液中滴入0.1mol/LKOH溶液至中性,此时溶液中以下关系一定正确的是___________(填字母).
A.c(H+)c(OH-)═1×10-14 mol2/L2
B.c(Na+)+c(K+)═c(HB-)+2c(A2-)
C.c(Na+)>c(K+)
D.c(Na+)+c(K+)═0.05mol/L
(3)已知常温下H2B的钙盐(CaB)饱和溶液中存在以下平衡:CaB(s) ![]() Ca2+(aq)+B2-(aq)△H>0.
Ca2+(aq)+B2-(aq)△H>0.
①温度升高时,Ksp ___________(填“增大”、“减小”或“不变”,下同)。
②滴加少量浓盐酸,c(Ca2+)___________,原因是___________(用文字和离子方程式说明)。
(4) 已知0.1molL-1NaHB溶液的pH=2,则0.1molL-1H2B溶液中氢离子的物质的量浓度可能是___________0.11molL-1(填“<”、“>”、或“=”); 理由是___________。
(5)0.1 mol/L NaHB溶液中各种离子浓度由大到小的顺序是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在锌与盐酸反应的实验中,某同学得到的结果如下表所示:
锌的质量/g | 锌的形状 | 温度/℃ | 锌完全溶解的时间/s | |
A | 2 | 薄片 | 5 | 400 |
B | 2 | 薄片 | 15 | 200 |
C | 2 | 薄片 | 25 | 100 |
D | 2 | 薄片 | 35 | t1 |
E | 2 | 颗粒 | 15 | t2 |
F | 2 | 粉末 | 15 | t3 |
G | 2 | 薄片(含少量杂质Cu) | 35 | t4 |
(1)反应的离子方程式是 ,该反应为 反应(填“放热”或“吸热”)。
(2)t1=________s, 完成下列时间对温度的曲线图(纵轴表示时间,横轴表示温度)。
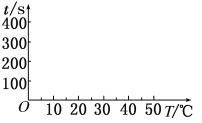
(3)利用所画的曲线图和相关数据,可得出该反应中温度影响反应速率的规律是__________。
(4)t1______(填“>”或“<”)t4,原因是________________________________。
t2________t3(填“>”或“<”),原因是_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
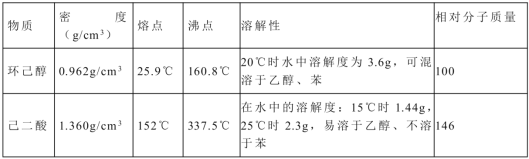
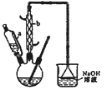
【题目】己二酸![]() 是一种工业上具有重要意义的有机二元酸,在化工生产、有机合成工业、医药、润滑剂制造等方面都有重要作用,能够发生成盐反应、酷化反应等,并能与二元醇缩聚成高分子聚合物等,己二酸产量居所有二元羧酸中的第二位。实验室合成己二酸的反应原理和实验装置示意图如下:
是一种工业上具有重要意义的有机二元酸,在化工生产、有机合成工业、医药、润滑剂制造等方面都有重要作用,能够发生成盐反应、酷化反应等,并能与二元醇缩聚成高分子聚合物等,己二酸产量居所有二元羧酸中的第二位。实验室合成己二酸的反应原理和实验装置示意图如下:![]()
可能用到的有关数据如下:
实验步骤如下:
Ⅰ、在三口烧瓶中加入16mL 50%的硝酸(密度为1.31g/cm),再加入1~2粒沸石,滴液漏斗中盛放有5.4mL环己醇。
Ⅱ、水浴加热三口烧瓶至50℃左右,移去水浴,缓慢滴加5~6滴环己醇,摇动三口烧瓶,观察到有红棕色气体放出时再慢慢滴加剩下的环己醇,维持反应温度在60℃~65 ℃之间。
Ⅲ、当环己醇全部加入后,将混合物用80℃-90℃水浴加热约10min(注意控制温度),直至无红棕色气体生成为止。
Ⅳ、趁热将反应液倒入烧杯中,放入冰水浴中冷却,析出晶体后过滤、洗涤得粗产品。
Ⅴ、粗产品经提纯后称重为5.7g。
请回答下列问题:
(1)滴液漏斗的细支管a的作用是________,仪器b的名称为________。
(2)己知用NaOH溶液吸收尾气时发生的相关反应方程式为:2NO2+2NaOH=NaNO2 +NaNO3 +H2O
NO+NO2+2NaOH =2NaNO2+H2O;如果改用纯碱溶液吸收尾气时也能发生类似反应,则相关反应方程式为:_________________、__________________;
(3)向三口烧瓶中滴加环己醇时,要控制好环己醇的滴入速率,防止反应过于剧烈导致温度迅速上升,否则可能造成较严重的后果,试列举一条可能产生的后果:_________________________________。
(4)为了除去可能的杂质和减少产品损失,可分别用冰水和________洗涤晶体。
(5)粗产品可用________法提纯(填实验操作名称)。本实验所得到的己二酸产率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有反应:mA(g)+nB(g) ![]() pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
(1)该反应的逆反应为________热反应,且m+n______p (填“>”、“=”或“<”) 。
(2)减压时,A的质量分数__________。(填“增大”、“减小”或“不变”,下同)
(3)若容积不变加入B,则B的转化率__________。
(4)若升高温度,则平衡时B、C的浓度之比将__________。
(5)若加入催化剂,平衡时气体混合物的总物质的量__________。
(6)若B是有色物质,A、C均无色,则加入C(体积不变)时混合物颜色__________;而维持容器内压强不变,充入氖气时,混合物颜色 。(填“变深”、“变浅”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列装置中,MSO4和NSO4是两种常见金属的易溶盐。当K闭合时,SO从右到左通过交换膜移向M极,下列分析正确的是( )
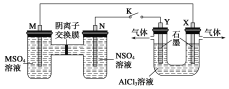
A.溶液中c(M2+)减小
B.N的电极反应式:N-2e-===N2+
C.X电极上有H2产生,发生还原反应
D.反应过程中Y电极周围生成白色胶状沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A是一种重要的基本化工原料,其分子中碳元素的百分含量为85.7%,且相对分子量小于30。A、B、C、D、E、F、G、H有下图所示的转化关系(部分产物已略去)。其中B为高分子化合物,C为无色无味气体,实验室中可以通过G与大理石制取。D为烃,不能使酸性高锰酸钾溶液褪色。E、G为生活中常见的有机物,且E有特殊香味,H有香味。
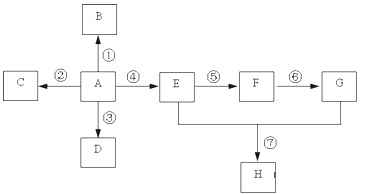
(1)写出下列各物质的官能团的名称:A ___________;E ___________;
(2)按要求写出下列各步变化的化学方程式(注明反应条件)
反应①_____________________________________________________;
反应④_____________________________________________________;
反应⑦ _____________________________________________________。
(3)写出下列反应类型:反应① ___________,反应②___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.如图是实验室制乙烯的发生装置和乙烯性质实验装置,反应原理为:CH3CH2OH![]() CH2===CH2↑+H2O,回答下列问题:
CH2===CH2↑+H2O,回答下列问题:
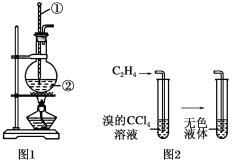
(1)图1中仪器①、②的名称分别为________、________。
(2)收集乙烯气体最好的方法是________。
(3)向溴的四氯化碳溶液中通入乙烯(如图2),溶液的颜色很快褪去,该反应属于____(填反应类型),反应的化学方程式为_______。
Ⅱ.实验室制取乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫。有人设计下列实验以确认上述混合气体中有乙烯和二氧化硫。试回答下列问题:
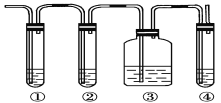
(1)图中①、②、③、④装置盛放的试剂是下列中的(将正确选项填入空格内):
①__________;②__________;③__________;④__________。
A.品红溶液 B.氢氧化钠溶液
C.浓硫酸 D.酸性高锰酸钾溶液
(2)能说明二氧化硫气体存在的现象是____________________。
(3)使用装置②的目的是________________________________。
(4)使用装置③的目的是_______________________________。
(5)验证含有乙烯的现象是________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com