
【题目】某科学家利用二氧化铈(CeO2)在太阳能作用下将H2O、CO2转变成H2、CO。其过程如下:mCeO2![]() (m-x)CeO2·xCe+xO2
(m-x)CeO2·xCe+xO2
(m-x)CeO2·xCe+xH2O+ xCO2![]() mCeO2+ xH2+ xCO
mCeO2+ xH2+ xCO
下列说法不正确的是( )
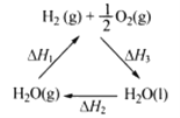
A.该过程中CeO2没有消耗
B.该过程实现了太阳能向化学能的转化
C.右图中△H1=△H2+△H3
D.以CO和O2构成的碱性燃料电池的负极反应式为CO+4OH——2e—=CO32-+2H2O
科目:高中化学 来源: 题型:
【题目】一种三室微生物燃料电池污水净化系统原理如右图所示。图中有机废水中有机物可用C6H10O5表示。下列有关说法正确的是
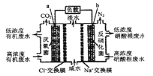
A.b电极为该电池的负极
B.b电极附近溶液的pH减小
C.a电极反应式:C6H10O5-24e-+7H2O═6CO2↑+24H+
D.中间室:Na+移向左室,Cl-移向右室
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在容积为2 L的密闭容器中投入一定量M、N进行反应,M、N的物质的量随时间的变化曲线如图所示:
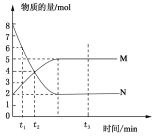
(1)写出此反应的化学方程式________________________。
(2)下列叙述中能说明上述反应达到平衡状态的是_____。
A.反应中M与N的物质的量之比为1:1
B.在混合气体中N的质量百分数保持不变
C.混合气体的平均摩尔质量不随时间的变化而变化
D.混合气体的压强不随时间的变化而变化
(3)若t3=3,则3min内用M表示的反应速率是 。
(4)在t2时刻正反应速率v(正)与逆反应速率v(逆)的大小关系是 。
(5)反应达到平衡后,N所占的体积分数是 (保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】印尼火山喷发不仅带来壮观的美景,还给附近的居民带来物质财富,有许多居民冒着生命危险在底部的火山口收集纯硫磺块来赚取丰厚收入。硫磺可用于生产化工原料硫酸。某工厂用下图所示的工艺流程生产硫酸:
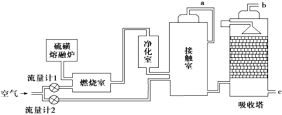
请回答下列问题:
(1)为充分利用反应放出的热量,接触室中应安装______________(填设备名称)。吸收塔中填充有许多瓷管,其作用是_____________________________________________。
(2)为使硫磺充分燃烧,经流量计1通入燃烧室的氧气过量50%,为提高SO2转化率,经流量计2的氧气量为接触室中二氧化硫完全氧化时理论需氧量的2.5倍,则生产过程中流经流量计1和流量计2的空气体积比应为________。假设接触室中SO2的转化率为95%,b管排出的尾气中二氧化硫的体积分数为__________(空气中氧气的体积分数按0.2计),该尾气的处理方法是________。
(3)与以硫铁矿为原料的生产工艺相比,该工艺的特点是________(可多选)。
A.耗氧量减少 B.二氧化硫的转化率提高
C.产生的废渣减少 D.不需要使用催化剂
(4)硫酸的用途非常广,可应用于下列哪些方面__________________________。
A.橡胶的硫化 B.表面活性剂“烷基苯磺酸钠”的合成
C.铅蓄电池的生产 D.过磷酸钙的制备
(5)矿物燃料的燃烧是产生大气中SO2的主要原因之一。在燃煤中加入适量的石灰石,可有效减少煤燃烧时SO2的排放,请写出此脱硫过程中反应的化学方程式_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇(CH3OH)是一种可再生能源,具有广泛的开发和应用前景。
(1)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH =-1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH =-566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH =-44.0 kJ/mol
请计算1 mol甲醇不完全燃烧生成1 mol一氧化碳和液态水放出的热量为________
(2)某实验小组依据甲醇燃烧的反应原理,设计如右图所示的电池装置。
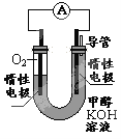
①工作一段时间后,测得溶液的pH 。(填“增大”“减小”“不变”)
②该电池负极的电极反应为 。
(3)某金属的相对原子质量为52.00,用上述电池电解该金属的一种含氧酸盐的酸性水溶液时,阳极每放出3 360 mL(标准状况)氧气,阴极析出金属10.4 g,在该含氧酸盐中金属的化合价为 ,
在该实验中,若不考虑能量的损失,电池中消耗甲醇的质量最少是 g(结果精确至0.1 g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食盐中含有一定量的镁、铁等杂质,加碘盐中碘的损失主要是由于杂质、水分、空气中的氧气以及光照、受热而引起的。已知:
氧化性:IO3﹣>Fe3+>I2;还原性:S2O32﹣>I﹣;3I2+6OH﹣═IO3﹣+5I﹣+3H2O;KI+I2![]() KI3
KI3
某学习小组对加碘盐进行如下实验:取一定量某加碘盐(可能含有KIO3、KI、Mg2+、Fe3+),用适量蒸馏水溶解,并加稀盐酸酸化,将所得溶液分为3份.第一份试液中滴加KSCN溶液后显红色;第二份试液中加足量KI固体,溶液显淡黄色,用CCl4萃取,下层溶液显紫红色;第三份试液中加入适量KIO3固体后,滴加淀粉试剂,溶液不变色。
(1)①第一份试液中滴加KSCN溶液显红色,该红色物质是 (用化学式表示);
②第二份试液中加入足量KI固体后,反应的离子方程式为 、 。
(2)①KI作为加碘剂的食盐在保存过程中,由于空气中氧气的作用,容易引起碘的损失。写出潮湿环境下KI与氧气反应的化学方程式: 。
②将I2溶于KI溶液,在低温条件下,可制得KI3H2O。该物质作为食盐加碘剂是否合适? (填“是”或“否”),并说明理由 。
(3)现向含6mol KI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加KBrO3的物质的量的关系如图所示。请回答下列问题:
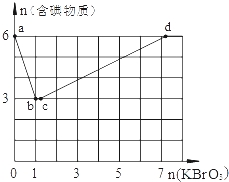
①已知b点时,KI反应完全,转移的电子数为 。
②b→c过程中,仅有一种元素的化合价发生了变化.则反应时氧化剂与还原剂的物质的量之比为 。
③d点时,n(KBrO3)为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下:
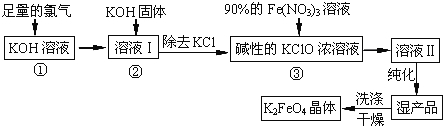
(1)反应①应在温度较低的情况下进行.因在温度较高时KOH 与Cl2 反应生成的是KClO3.写出在温度较高时KOH 与Cl2反应的化学方程式 ;
(2)在反应液I中加入KOH固体的目的是 (填编号);
A.与反应液I中过量的Cl2继续反应,生成更多的KClO
B.KOH固体溶解时会放出较多的热量,有利于提高反应速率
C.为下一步反应提供碱性的环境
D.使KClO3转化为 KClO
(3)从溶液II中分离出K2FeO4后,还会有副产品KNO3、KCl,则反应③中发生的离子反应方程式为 。
(4)如何判断K2FeO4晶体已经洗涤干净 。
(5)高铁酸钾(K2FeO4)作为水处理剂的一个优点是能与水反应生成胶体吸附杂质,其离子反应是: FeO42﹣+ H2O= Fe(OH)3(胶体)+ O2↑+
完成并配平上述反应的离子方程式。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由环己烷可制得1,4-环己二醇,流程如下(其中无机产物都已略去),试回答:

(1)反应_________属于取代反应(填反应序号).
(2)化合物的结构简式:B______________,C_______________.
(3)反应⑥所用试剂和条件是________________________.
(4)写出反应②、⑤的化学方程式:反应②________________反应⑤__________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理研究碳、氮的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
(1)已知反应CO(g)+2H2(g)![]() CH3OH(g) ΔH=-99kJ·mol-1中的相关化学键能如下:
CH3OH(g) ΔH=-99kJ·mol-1中的相关化学键能如下:
![]()
则x= 。
(2)甲醇作为一种重要的化工原料,既可以作为燃料,还可用于合成其它化工原料。在一定条件下可利用甲醇羰基化法制取甲酸甲酯,其反应原理可表示为:CH3OH(g) +CO(g) ![]() HCOOCH3(g) ΔH=-29.1kJ·mol-1。向体积为2L的密闭容器中充入2mol CH3OH(g) 和2mol CO,测得容器内的压强(p:kPa)随时间(min)的变化关系如下图中Ⅰ、Ⅱ、Ⅲ曲线所示:
HCOOCH3(g) ΔH=-29.1kJ·mol-1。向体积为2L的密闭容器中充入2mol CH3OH(g) 和2mol CO,测得容器内的压强(p:kPa)随时间(min)的变化关系如下图中Ⅰ、Ⅱ、Ⅲ曲线所示:

①Ⅱ和Ⅰ相比,改变的反应条件是 。
②反应Ⅰ在5min时达到平衡,在此条件下从反应开始到达到平衡时v(HCOOCH3)= 。
③反应Ⅱ在2min时达到平衡,平衡常数K(Ⅱ) = 。在体积和温度不变的条件下,在上述反应达到平衡Ⅱ时,再往容器中加入1mol CO和2mol HCOOCH3后v(正) v(逆)(填“﹥”“﹤”“﹦”),原因是 。
④比较反应Ⅰ的温度(T1)和反应Ⅲ的温度(T3)的高低:T1 T3(填“﹥”“﹤”“﹦”),判断的理由是 。
(3)超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2。某研究小组在实验室用某新型催化剂对CO、NO催化转化进行研究,测得NO转化为N2的转化率随温度、CO混存量的变化情况如下图所示,利用以下反应填空:
NO+CO![]() N2+ CO2(有CO) 2NO
N2+ CO2(有CO) 2NO![]() N2+ O2(无CO)
N2+ O2(无CO)
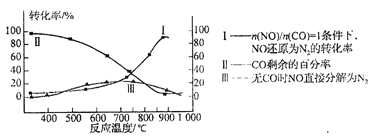
①若不使用CO,温度超过775℃,发现NO的分解率降低,其可能的原因为 。
②在n(NO)/ n(CO)=1的条件下,应控制最佳温度在 左右。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com