
����Ŀ���״�(CH3OH)��һ�ֿ�������Դ�����й㷺�Ŀ�����Ӧ��ǰ����
��1����֪�ڳ��³�ѹ�£�
�� 2CH3OH(l) �� 3O2(g) �� 2CO2(g) �� 4H2O(g) ��H ����1275.6 kJ��mol
�� 2CO (g)+ O2(g) �� 2CO2(g) ��H ����566.0 kJ��mol
�� H2O(g) �� H2O(l) ��H ����44.0 kJ��mol
�����1 mol�״�����ȫȼ������1 molһ����̼��Һ̬ˮ�ų�������Ϊ________
��2��ijʵ��С�����ݼ״�ȼ�յķ�Ӧԭ�����������ͼ��ʾ�ĵ��װ�á�
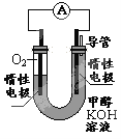
������һ��ʱ������Һ��pH ��(��������������С����������)
���õ�ظ����ĵ缫��ӦΪ ��
��3��ij���������ԭ������Ϊ52.00����������ص��ý�����һ�ֺ������ε�����ˮ��Һʱ������ÿ�ų�3 360 mL(��״��)������������������10.4 g���ڸú��������н����Ļ��ϼ�Ϊ ��
�ڸ�ʵ���У�����������������ʧ����������ļ״������������� g(�����ȷ��0.1 g)
���𰸡�
��1��442.8KJ
��2������CH3OH �C 6e�� + 8OH�� === CO32�� +6H2O
��3��+3��3.2
��������
�����������1����2CH3OH(l)+3O2(g)�T2CO2(g)+4H2O(g)��H=-1275.6kJmol-1����2CO(g)+O2(g)�T2CO2(g) ��H=-566.0kJmol-1����H2O(g)�TH2O(l)��H=-44.0kJmol-1�����ݸ�˹���ɣ�����֪��Ӧ![]() ��(��-��+�ۡ�4)�õ�CH3OH(l)+O2(g)=CO(g)+2H2O(l)�����Ը÷�Ӧ����H=
��(��-��+�ۡ�4)�õ�CH3OH(l)+O2(g)=CO(g)+2H2O(l)�����Ը÷�Ӧ����H=![]() ��[(-1275.6kJ/mol)-(-566.0kJ/mol)+ (-44.0kJ/mol)��4] =-442.8kJmol-1����CH3OH(l)+O2(g) =CO(g)+ 2H2O(l) ��H=-442.8kJmol-1�����1mol�״�����ȫȼ������1molһ����̼��Һ̬ˮ�ų�������Ϊ442.8kJ���ʴ�Ϊ��442.8kJ��
��[(-1275.6kJ/mol)-(-566.0kJ/mol)+ (-44.0kJ/mol)��4] =-442.8kJmol-1����CH3OH(l)+O2(g) =CO(g)+ 2H2O(l) ��H=-442.8kJmol-1�����1mol�״�����ȫȼ������1molһ����̼��Һ̬ˮ�ų�������Ϊ442.8kJ���ʴ�Ϊ��442.8kJ��
��2����CH3OH+8OH--6e-=CO32-+6H2O�����������ӱ����ģ�������Һ��pH��С���ʴ�Ϊ����С��
����ȼ�ϵ���У�������ȼ�Ϸ���ʧ���ӵ�������Ӧ����CH3OH+8OH--6e-=CO32-+6H2O���ʴ�Ϊ��CH3OH+8OH--6e-=CO32-+6H2O��
��3��������Ļ��ϼ�Ϊx������ݵ�ʧ�����غ��ϵ�ɵ�![]() ��4=
��4=![]() ��x�����x=3��
��x�����x=3��
n(O2)=![]() =0.15mol���õ�0.15mol��4=0.6mol���ӣ���CH3OH+8OH--6e-=CO32-+6H2O��֪��0.1mol�״�ʧȥ0.6mol���ӣ���˼״�������Ϊ0.1mol��32g/mol=3.2g���ʴ�Ϊ��+3��3.2��
=0.15mol���õ�0.15mol��4=0.6mol���ӣ���CH3OH+8OH--6e-=CO32-+6H2O��֪��0.1mol�״�ʧȥ0.6mol���ӣ���˼״�������Ϊ0.1mol��32g/mol=3.2g���ʴ�Ϊ��+3��3.2��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ�п��ܺ���H����Na����NH4+��Fe3����Al3����SO![]() ��CO
��CO![]() �����ӡ��������Һ�м���һ�����ʵ���Ũ�ȵ�NaOH��Һʱ���������ɳ������ʵ�����NaOH��Һ����仯��ͼ����ͼ��ʾ������˵����ȷ������ ��
�����ӡ��������Һ�м���һ�����ʵ���Ũ�ȵ�NaOH��Һʱ���������ɳ������ʵ�����NaOH��Һ����仯��ͼ����ͼ��ʾ������˵����ȷ������ ��
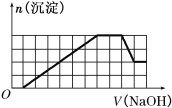
A��ԭ��Һ�к��е���������H����Fe3����Al3��
B��ԭ��Һ��һ������SO![]() ��Na��
��Na��
C��ԭ��Һ�к��е�Fe3����Al3�������ʵ���֮��Ϊ1��1
D����Ӧ����γɵ���Һ�к��е�����ΪNa2SO4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ǹ�ϰ�˳����ļ��ֽ�����Na��Mg��Al��Fe��Cu������������ѧ֪ʶ�ش��������⣺
��1����ԭ�Ӻ��������________�˶�״̬���仯����Na2O2������________________��
��2��þ�ڶ�����̼�е�ȼ�Ļ�ѧ����ʽΪ______________________________��
��3������Ԫ�����ڱ���λ��______________________________��
��4����ȥFe�е�����Al��������Ӧ�����ӷ���ʽΪ_____________________________��
��5�����漸�ֽ����п����Ȼ�ԭ��ұ������______________________________��
��6��ͭ�ļ۵����Ų�ʽΪ3d104s1������3d94s2������_________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����û�ѧ��Ӧԭ���о�̼�����ȵ��ʺͻ�����ķ�Ӧ����Ҫ���塣
��1���п�ѧ�����������FeO���պ�����CO2������Ȼ�ѧ����ʽ������
6 FeO(s)+CO2(g)=2Fe3O4(s)+C(s) ��H= -76.0 kJ��molһ1
��������Ӧ��ÿ����1 mol Fe3O4��ת�Ƶ��ӵ����ʵ���Ϊ_______mol��
����֪��C(s)+2H2O(g)=CO2 (g)+2H2(g) ��H=+113.4 kJ��molһ1����Ӧ��
3 FeO(s)+ H2O (g)= Fe3O4 (s)+ H2 (g)����H=__________��
��2����ҵ����������NH3(g)��CO2(g)��������Ӧ�������ء�CO(NH2)2����������Ӧ�������仯ʾ��ͼ���£�
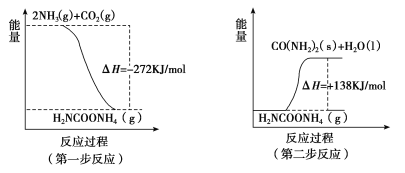
��NH3(g)��CO2(g)��Ӧ�������ص��Ȼ�ѧ����ʽΪ____________________��
��3�������ڴ�����ȼ�գ�����һ�ֵ��ʺ�ˮ����ѧ�����ô�ԭ������Ƴɰ���һ����ȼ�ϵ�أ���ͨ�백���ĵ缫�� (��������������������)�����������£��õ缫������Ӧ�ĵ缫��ӦʽΪ ��
��4����ʢ�ٴ�ѧ���о���Ա�о���һ�ַ�������ʵ��ˮ������ʱCO2���ŷţ������ԭ����ͼ��ʾ��
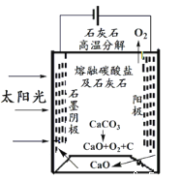
�������������̵�����ת����ʽ��_____________��
a������ת��Ϊ��ѧ��
b��̫����ת��Ϊ����
c��̫����ת��Ϊ��ѧ��
d����ѧ��ת��Ϊ����
��������ⷴӦ���¶�С�� 900��ʱ���У�̼����ȷֽ�ΪCaO��CO2�������Ϊ����̼���ƣ�������ӦʽΪ3CO2��4e��=C��2CO32-���������ĵ缫��ӦʽΪ_________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ�����ö�������(CeO2)��̫���������½�H2O��CO2ת���H2��CO����������£�mCeO2![]() (m-x)CeO2��xCe+xO2
(m-x)CeO2��xCe+xO2
(m-x)CeO2��xCe+xH2O+ xCO2![]() mCeO2+ xH2+ xCO
mCeO2+ xH2+ xCO
����˵������ȷ����( )
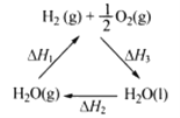
A���ù�����CeO2û������
B���ù���ʵ����̫������ѧ�ܵ�ת��
C����ͼ����H1=��H2+��H3
D����CO��O2���ɵļ���ȼ�ϵ�صĸ�����ӦʽΪCO+4OH����2e��=CO32-+2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������̫���ܵ�ص���Ҫ���ϡ���ҵұ�������ԭ���ǣ�
�ֹ�ұ������SiO2 + 2C![]() Si + 2CO
Si + 2CO
�����裺��Si + 3HCl![]() SiHCl3 + H2
SiHCl3 + H2
��SiHCl3 + H2![]() Si + 3HCl
Si + 3HCl
��ѧ��Ӧ�������仯��ͼ��ʾ���ش��������⣺
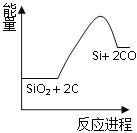
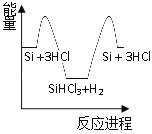
��1����Ӧ����_________��Ӧ(��������������������)����Ӧ����_________��Ӧ(��������������������)��
��2����Ӧ���ƻ���Ӧ���еĻ�ѧ�������յ�����_________�γ��������л�ѧ�����ų�������(��������������С����)��
��3���о����ʱ仯ʱ�����ǿ��ԴӲ�ͬ�Ƕȡ���ͬ��������ʶ���ʱ仯ʱ������Ļ�ѧ���������仯���ݴ��ж�����˵���������_________(˫ѡ)��
A�������ƺ�������Ӧ�����Ȼ��ƺ���ṹ���ȶ�����ǿ����ϵ����������
B���������������������ֱ���ȫȼ�գ�ǰ�߷ų���������
C�����������ڲ������ź�ǿ�Ĺ��ۼ�����ͨ��״���µ����Ļ�ѧ���ʺܻ���
D����ʯī��ȡ���ʯ�����ȷ�Ӧ����֪���ʯ��ʯī�ȶ�
E���ɷ��ȷ�ӦH2 + Cl2 ==== 2HCl��˵������1mol H��H����1molCl��Cl�������յ�����С���γ�2molH��Cl�����ų�������
��4�����о���ѧ��Ӧ�е������仯ʱ������ͨ����������ʵ�飺
��һ��С�ձ������20g�Ѿ���ĥ�ɷ�ĩ�������������塾Ba(OH)2.8H2O������С�ձ����������ѵ���3��4��ˮ�IJ���Ƭ�ϣ�Ȼ�����ձ��м���Լ10gNH4Cl���壬�������ò�����Ѹ�ٽ��衣д��ʵ������з�����Ӧ�Ļ�ѧ����ʽ_________���÷�Ӧ�з�Ӧ��������_________�������������(��������������С����)��ʵ������������ò�����Ѹ�ٽ����ԭ����_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���⼰�仯�����ںϳ�ɱ������ҩ��ȷ�����й㷺��;���ش��������⣺
��1�������ĵ⸻���ں����У���ˮ��ȡ��Ũ��������Ũ��Һ�м�MnO2��H2SO4�����ɵõ�I2���÷�Ӧ�Ļ�ԭ����Ϊ___________��
��2������Ũ��Һ�к���I-��Cl-�����ӣ�ȡһ������Ũ��Һ�������еμ�AgNO3��Һ����AgCl��ʼ����ʱ����Һ��![]() Ϊ��___________����֪Ksp(AgCl)=1.8��10-10��Ksp(AgI)=8.5��10-17��
Ϊ��___________����֪Ksp(AgCl)=1.8��10-10��Ksp(AgI)=8.5��10-17��
��3����֪��Ӧ2HI(g)![]() H2(g)+I2(g)�ġ�H=+11kJmol-1��1molH2(g)��1molI2(g)�����л�ѧ������ʱ�ֱ���Ҫ����436kJ��151kJ����������1molHI(g)�����л�ѧ������ʱ�����յ�����Ϊ___________ kJ��
H2(g)+I2(g)�ġ�H=+11kJmol-1��1molH2(g)��1molI2(g)�����л�ѧ������ʱ�ֱ���Ҫ����436kJ��151kJ����������1molHI(g)�����л�ѧ������ʱ�����յ�����Ϊ___________ kJ��
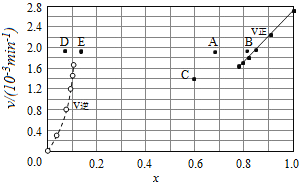
��4��Bodensteins�о������з�Ӧ��2HI(g)![]() H2(g)+I2(g)����716Kʱ�����������е⻯������ʵ�������x(HI)�뷴Ӧʱ��t�Ĺ�ϵ�����
H2(g)+I2(g)����716Kʱ�����������е⻯������ʵ�������x(HI)�뷴Ӧʱ��t�Ĺ�ϵ�����
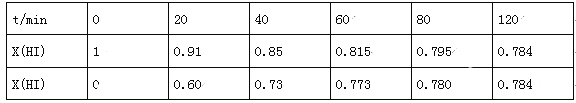
�ٸ�������ʵ�������÷�Ӧ��ƽ�ⳣ��K�ļ���ʽΪ��___________��
��������Ӧ�У�����Ӧ����Ϊv��=k��x2(HI)���淴Ӧ����Ϊv��=k��x(H2)x(I2)������k����k��Ϊ���ʳ�������k��Ϊ___________(��K��k����ʾ)����k��=0.0027min-1����t=40minʱ��v��=___________min-1��
��������ʵ�����ݼ���õ�v����x(HI)��v����x(H2)�Ĺ�ϵ������ͼ��ʾ�������ߵ�ijһ�¶�ʱ����Ӧ���´ﵽƽ�⣬��Ӧ�ĵ�ֱ�Ϊ___________(����ĸ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������ĸ�ҹ����������������(NaNO2)�������س��������ʳ�õ�˵����ij��ȤС�鿪չ����̽�����
�һ����������
NaNO2�ж������������Ժͻ�ԭ�ԣ�NaNO2��Һ�Լ��ԣ������ڷ��ù����У�NaNO3��ת��ΪNaNO2�����ҹ涨����Ʒ��NaNO2�������ܳ���30 mg/kg��
���������NaNO2��ʳ��
��1��NaNO2��ʳ�ε�������ƣ��ױ�����ʳ�����ã������������ּ�����
�� �ܷ��ȡ������������ͷƷ����_____��(ѡ��������ܡ�)
�� ��ϡ���ᡢ���ۺ�KI��Һ������Һ��������NaNO2����___�ԡ�
�����̽��NaNO3��NaNO2���ת��
��2����ȡNaNO2��NaNO3�����Һ��װ����ͼ��ʾ��
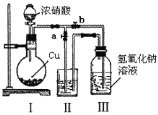
��֪��2NO2+2NaOH=NaNO2+NaNO3+H2O��
�� д��װ��I�з�����Ӧ�Ļ�ѧ����ʽ___________________________________��
�� ˮ_______(ѡ���"���ܡ�)��Ϊװ��II�е��Լ���������_________________��
�� װ��III�з�Ӧ��ȫ�������IJ�����_________________________________��
��3����NaNO2��NaNO3�����Һ¶���ڿ�������ҹ�����Һ��pH��С������Һ��NaNO2�ĺ���_______(ѡ����ࡱ��������"���䡱)��ԭ�������______________���û�ѧ����ʽ���ͣ���
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com