
【题目】与“实验操作”相对应的“实验现象”的字母代号填入答案栏中
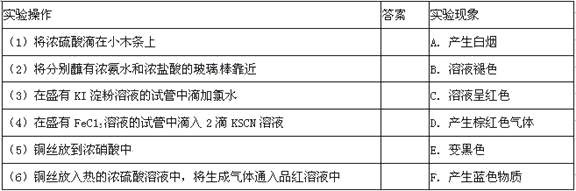
【答案】ABCDEF
【解析】试题分析:(1)将浓硫酸滴在小木条上,浓硫酸具有脱水性,使小木条炭化变黑,答案选E;
(2)将分别蘸有浓氨水和浓盐酸的玻璃棒靠近,挥发出的氨气和氯化氢气体结合生成氯化铵固体,生成白烟,答案选A;
(3)在盛有KI淀粉溶液的试管中滴加氯水,氯水具有强氧化性,可将I-氧化为I2,I2遇淀粉变蓝,答案选F;
(4)在盛有FeC13溶液的试管中滴入2滴KSCN溶液,三价铁遇KSCN溶液出现血红色,答案选C。
(5)铜丝放到浓硝酸中反应生成硝酸铜、NO2和水,答案选D。
(6)铜丝放入热的浓硫酸溶液中,有二氧化硫生成,将生成气体通入品红溶液中,二氧化硫具有漂白性,品红褪色,答案选B。


 灵星计算小达人系列答案
灵星计算小达人系列答案科目:高中化学 来源: 题型:
【题目】根据表中短周期元素性质的数据判断,下列说法一定错误的是

A. ④是周期表中非金属性最强的元素
B. ①是周期表中原子半径最小的元素
C. ②④⑤在位于同一个周期
D. ①③两元素组成的化合物分子与③④两元素组成的化合物分子空间构型相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了预防碘缺乏症,国家规定每千克食盐中应含有40~50 mg碘酸钾。碘酸钾晶体具有较高的稳定性,但在酸性溶液中,碘酸钾是一种较强的氧化剂,能跟某些还原剂反应生成碘;在碱性溶液中,碘酸钾能被氯气、次氯酸等更强的氧化剂氧化为更高价的碘的含氧酸盐。工业生产碘酸钾的流程如图所示。
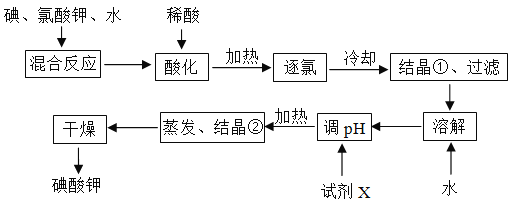
(1)碘在周期表中的位置为__________________;
(2)碘、氯酸钾、水混合反应时,若两种还原产物所得电子的数目相同,请配平该反应的化学方程式:____I2+____KClO3+____H2O=____KH(IO3)2+____KCl+____Cl2↑;
(3)混合反应后,用稀酸酸化的作用是___________________________,在稀盐酸和稀硝酸中不能选用的酸是_________,理由是__________________________________;
(4)试剂X的化学式为__________,写出用试剂X调pH的化学方程式__________________;
(5)如果省略“酸化”、“逐氯”、“结晶①、过滤”这三步操作,直接用试剂X调整反应混合物的pH,对生产碘酸钾有什么影响?________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ如图所示:已知甲、乙、丙常温下都为气体。
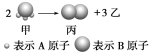
(1)乙气体的分子式 。(用A、B表示,A、B可以选择性使用)
(2)若测得生成物的混合气体对氢气的相对密度为d,则甲的摩尔质量为 。(用d表示)
(3)标准状况下,11.2L甲气体溶于500mL水中,所得溶液的密度为ρg/cm3,则所得溶液中甲的物质的量浓度为 (用d、ρ表示)(甲的摩尔质量用(2)中的数据)。
Ⅱ完成下列离子方程式。
(1)贝壳溶于醋酸溶液: 。
(2)向氢氧化钡溶液中加入少量小苏打溶液: 。
(3)碳酸氢铵和足量浓烧碱溶液混合: 。
(4)向次氯酸钠溶液中通足量SO2气体: 。
(5)向溴化亚铁溶液中通入足量氯气: 。
(6)向偏铝酸钠溶液中通入足量CO2气体: 。
(7)向硫酸亚铁溶液中加入酸性高锰酸钾溶液: 。
(8)金属锌和硫酸、三氧化二砷反应生成砷化氢: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 常温下,醋酸和氨水的电离平衡常数均为1.8×10-5。向10mL浓度为0.1molL-1的NH3H2O溶液中滴加相同浓度的CH3COOH(温度变化忽略不计),在滴加过程中( )
A.c(NH4+)与c(NH3H2O)之和始终保持不变
B.水的电离程度始终增大
C.![]() 始终减小
始终减小
D.当加入CH3COOH的体积为10mL时,溶液pH>7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种三室微生物燃料电池污水净化系统原理如右图所示。图中有机废水中有机物可用C6H10O5表示。下列有关说法正确的是
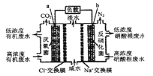
A.b电极为该电池的负极
B.b电极附近溶液的pH减小
C.a电极反应式:C6H10O5-24e-+7H2O═6CO2↑+24H+
D.中间室:Na+移向左室,Cl-移向右室
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铜晶体,俗称蓝矾、胆矾,具有催吐,祛腐,解毒。取5.0 g胆矾样品逐渐升高温度使其分解,分解过程的热重如下表。回答下列问题:
温度范围/℃ | 固体质量/g |
258~680 | 3.20 |
680~1000 | 1.60 |
1000以上 | 1.44 |
(1)测定蓝矾属于晶体的物理方法是____________。其中SO42-中S原子的轨道杂化形式是____________;H2O的空间构型是__________________。
(2)将硫酸铜晶体加热到258~680℃生成的物质A,A是__________(化学式);A溶于水配成溶液,加入氨水,观察到的现象是_____________________________________________;最终得到溶液中的含铜元素的离子是_________________(化学式),该离子含有的化学键类型有___________________。
(3)将硫酸铜晶体加热到1000℃以上生成的物质C,在C中的铜的离子的基态电子排布式是____________;
(4)如图是硫酸铜晶体分解得到一定温度的产物的晶胞(白球和黑球代表不同的原子)。
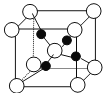
①该温度是_______________。
②铜原子的配位数是_______________。
③已知该晶体的密度为dg·cm-3,则晶胞参数是_________________pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据化学反应中的能量变化关系回答下列问题:
(1)断开1molH-H键,1molN-H键,1molN≡N键分别需要吸收的能量为436kJ、391kJ、946kJ,求:
①1molN2生成NH3需______(填“吸收”或“放出”)能量______kJ;
②1molH2生成NH3需______(填“吸收”或“放出”)能量______kJ。
(2)航天飞船可用肼(N2H4)作动力源。已知1mol液态肼和足量的液态过氧化氢反应生成氮气和水蒸气时放出641.6kJ热量,化学方程式如下:N2H4+2H2O2===N2↑+4H2O。
①该反应中肼作 (填氧化或还原)剂;
②该反应的反应物总能量 (填高于或低于)生成物的总能量;
③此情况下,液态肼燃烧生成0.5molN2时放出的热量为 kJ;
④肼(N2H4)分子中存在的化学键有 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇(CH3OH)是一种可再生能源,具有广泛的开发和应用前景。
(1)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH =-1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH =-566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH =-44.0 kJ/mol
请计算1 mol甲醇不完全燃烧生成1 mol一氧化碳和液态水放出的热量为________
(2)某实验小组依据甲醇燃烧的反应原理,设计如右图所示的电池装置。
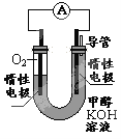
①工作一段时间后,测得溶液的pH 。(填“增大”“减小”“不变”)
②该电池负极的电极反应为 。
(3)某金属的相对原子质量为52.00,用上述电池电解该金属的一种含氧酸盐的酸性水溶液时,阳极每放出3 360 mL(标准状况)氧气,阴极析出金属10.4 g,在该含氧酸盐中金属的化合价为 ,
在该实验中,若不考虑能量的损失,电池中消耗甲醇的质量最少是 g(结果精确至0.1 g)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com