
【题目】Ⅰ如图所示:已知甲、乙、丙常温下都为气体。
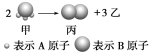
(1)乙气体的分子式 。(用A、B表示,A、B可以选择性使用)
(2)若测得生成物的混合气体对氢气的相对密度为d,则甲的摩尔质量为 。(用d表示)
(3)标准状况下,11.2L甲气体溶于500mL水中,所得溶液的密度为ρg/cm3,则所得溶液中甲的物质的量浓度为 (用d、ρ表示)(甲的摩尔质量用(2)中的数据)。
Ⅱ完成下列离子方程式。
(1)贝壳溶于醋酸溶液: 。
(2)向氢氧化钡溶液中加入少量小苏打溶液: 。
(3)碳酸氢铵和足量浓烧碱溶液混合: 。
(4)向次氯酸钠溶液中通足量SO2气体: 。
(5)向溴化亚铁溶液中通入足量氯气: 。
(6)向偏铝酸钠溶液中通入足量CO2气体: 。
(7)向硫酸亚铁溶液中加入酸性高锰酸钾溶液: 。
(8)金属锌和硫酸、三氧化二砷反应生成砷化氢: 。
【答案】
Ⅰ (1) A2
(2) 4dg·mol-1
(3)500ρ/(2d+500) mol/L
Ⅱ(1)CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑
(2) HCO3- +Ba2++OH-=BaCO3↓+H2O
(3) NH4++HCO3-+2OH-=NH3+CO32-+2H2O
(4) ClO-+SO2+H2O=SO42- +Cl-+2H+
(5)2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl- (6)AlO2- +CO2+2H2O=Al(OH)3↓+HCO3-
(7)5Fe2++MnO4-+8H+=5Fe3++Mn2++ 4H2O (8) As2O3+6Zn+12H+=2AsH3↑+6Zn2++3H2O
【解析】
试题分析:Ⅰ、(1)已知甲、乙、丙常温下都为气体.2mol甲分子反应生成1mol丙和3mol乙,根据结构模型可设甲的分子式为BA3,丙为B2,则乙为A2;
(2)混合气体对氢气的相对密度为d,则生成物的相对分子质量为2d,2mol甲可生成1mol丙和3mol乙,则可知甲的摩尔质量为4d gmol-1;
(3)甲的物质的量为11.2L÷22.4L/mol=0.5mol,质量为0.5mol×4d gmol-1=2d g,500mL水的质量为500g,则溶液的质量为(500+2d)g,溶液的体积为![]() ,则物质的量浓度为
,则物质的量浓度为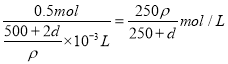 。
。
Ⅱ、(1)贝壳溶于醋酸溶液的离子方程式为CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑。
(2)向氢氧化钡溶液中加入少量小苏打溶液的离子方程式为HCO3- +Ba2++OH-=BaCO3↓+H2O。
(3)碳酸氢铵和足量浓烧碱溶液混合反应的离子方程式为NH4++HCO3-+2OH-=NH3+CO32-+2H2O。
(4)向次氯酸钠溶液中通足量SO2气体发生氧化还原反应的离子方程式为ClO-+SO2+H2O=SO42- +Cl-+2H+。
(5)向溴化亚铁溶液中通入足量氯气的离子方程式为2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-。
(6)向偏铝酸钠溶液中通入足量CO2气体的离子方程式为AlO2- +CO2+2H2O=Al(OH)3↓+HCO3-。
(7)向硫酸亚铁溶液中加入酸性高锰酸钾溶液发生氧化还原反应的离子方程式为5Fe2++MnO4-+8H+=5Fe3++Mn2++ 4H2O。
(8)金属锌和硫酸、三氧化二砷反应生成砷化氢的离子方程式为As2O3+6Zn+12H+=2AsH3↑+6Zn2++3H2O。


 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源: 题型:
【题目】化合物H是合成治疗高血压药物奈必洛尔的重要中间体,其部分合成路线图如下(Ph代表苯基):
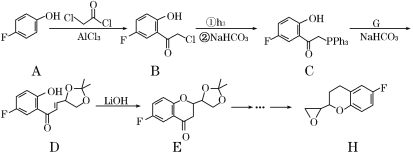
(1)化合物C的含氧官能团名称为________、________。
(2)B→C的反应类型是________。
(3)写出A→B的化学反应方程式________。
(4)C→D的转化中,反应物G的分子式为C6H10O3,生成物除D外还有Ph3P=O,则G的结构简式为_________
(5)写出同时满足下列条件的B的一种同分异构体的结构简式________。
Ⅰ.分子中含有一个酯基和一个手性碳原子,有4种化学环境不同的氢;
Ⅱ.不能发生银镜反应;
Ⅲ.能发生水解反应,且其中一种水解产物能与FeCl3溶液发生显色反应。
(6)已知:
①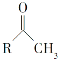
![]() RCOONa
RCOONa
②![]()
![]()
![]()
化合物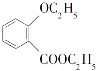 是一种重要的有机合成中间体,请写出以苯酚、乙醇和
是一种重要的有机合成中间体,请写出以苯酚、乙醇和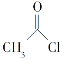 为原料制备该化合物的合成路线流程图(无机试剂作用)。合成路线流程图示例如下:
为原料制备该化合物的合成路线流程图(无机试剂作用)。合成路线流程图示例如下:
H2C===CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH
CH3CH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在有机物分子中,当碳原子连有4个不同的原子或原子团时,这种碳原子称为“手性碳原子”。凡具有一个手性碳原子的化合物一定具有光学活性。例如,有机物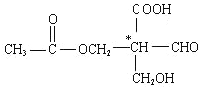 含有一个手性碳原子,具有光学活性,当发生下列化学变化,生成的新有机物仍有光学活性的是( )
含有一个手性碳原子,具有光学活性,当发生下列化学变化,生成的新有机物仍有光学活性的是( )
A、与NaOH溶液共热 B、与银氨溶液共热
C、与金属钠反应 D、与氢气发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以乙烯为原料合成环状化合物 E(C4H4O4)的流程如下。
![]()
请回答下列问题:
(1)E 的结构简式是_______________;C 中所含官能团的名称是____________。
(2)在乙烯的同系物中,所有碳原子一定共平面且碳原子数最多的分子的结构简式是__________,名称(系统命名)是______________。
(3)反应①⑤中,属于取代反应的是_______(填写编号)。
(4)写出反应②的化学方程式______________ 。
(5)F是E的同分异构体,且1 mol F与足量的 NaHCO3溶液反应可放出2mol CO2气体,请写出符合条件的F的所有的结构简式______________ 。
(6)参照上述合成路线的表示,设计以乙烯为原料制备乙二醇的最简合成路线:
__________________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知乙烯能发生以下转化:

(1)乙烯的结构简式为: 。
(2)写出B、D化合物中官能团的名称:B ;D ;
(3)写出反应的化学方程式
①: 反应类型:
②: 反应类型:
③: 反应类型:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛是一种性能非常优越的金属,它化学性质稳定,耐腐蚀、钛及钛合金主要用于飞机、火箭、导弹、人造卫星和宇宙飞船等领域,某实验室模拟硫酸法生产二氧化钛,实验流程如下:
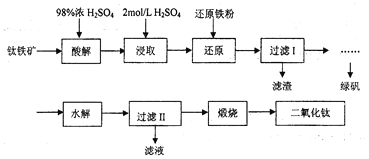
(1)酸解过程中发生的主要反应如下:FeTiO3+3H2SO4=Ti(SO4)2+FeSO4+3H2O 请补充生成TiOSO4的化学方程式________________________________________;
(2)若取5g钛铁矿(主要成分是FeTiO3,含少量Fe2O3)于蒸发皿,加适量98%浓硫酸(密度1.84g/cm3)加热,请选择最接近的浓硫酸的用量_____________(填序号)。
A.2mL B.6mL C.25mL D.100mL
(3)在酸解后的浸取过程中,为提高浸出率可采用的方法有_____________。(任答一点)
(4)加“还原铁粉”的目的_____________。
(5)请根据FeSO4溶解度曲线,补充由过虑I中滤液获得副产品绿矾(FeSO4·7H2O)的具体操作:取过滤I所得的滤液_______________________________________________________________。
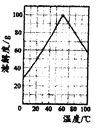
(6)“水解”过程的操作步骤:将滤液加热至90℃,加6~7倍体积的溺水,保持沸腾60min,减压过滤,用2mol/LH2SO4溶液洗涤沉淀,请思考,“将滤液加热至90℃”作用是_____________________________。沉淀用2mol/LH2SO4溶液洗涤而不是用水洗涤的原因_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数小于36的X、Y、Z、W四种元素,其中X是宇宙中含量最多的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的+1价阳离子的核外有3个电子层且各层均充满。
回答下列问题:
(1)W+的价电子排布式为 。
(2)Y2X2分子中Y原子轨道的杂化类型为 ,1mol Y2X2含有σ键的数目为 。
(3)化合物ZX3的沸点比化合物YX4的高,其主要原因是 。
(4)元素Y的一种氧化物与元素Z的一种氧化物互为等电子体,元素Z的这种氧化物的分子式是 。
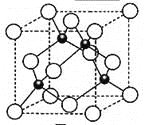
(5)元素W的一种氯化物晶体的晶胞结构如图所示,该氯化物的化学式是 ,它可与浓盐酸发生非氧化还原反应,生成配合物H2WCl3,反应的化学方程式为 。在晶胞中最近的2个原子距离是apm,晶胞的密度是_____________g·cm-3(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近我们复习了常见的几种金属:Na、Mg、Al、Fe、Cu。请结合我们所学知识回答下列问题:
(1)钠原子核外电子有________运动状态,其化合物Na2O2可用作________________。
(2)镁在二氧化碳中点燃的化学方程式为______________________________。
(3)铝在元素周期表中位于______________________________。
(4)除去Fe中的杂质Al所发生反应的离子方程式为_____________________________。
(5)上面几种金属中可用热还原法冶炼的是______________________________。
(6)铜的价电子排布式为3d104s1而不是3d94s2是依据_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com