
【题目】硫酸铜晶体,俗称蓝矾、胆矾,具有催吐,祛腐,解毒。取5.0 g胆矾样品逐渐升高温度使其分解,分解过程的热重如下表。回答下列问题:
温度范围/℃ | 固体质量/g |
258~680 | 3.20 |
680~1000 | 1.60 |
1000以上 | 1.44 |
(1)测定蓝矾属于晶体的物理方法是____________。其中SO42-中S原子的轨道杂化形式是____________;H2O的空间构型是__________________。
(2)将硫酸铜晶体加热到258~680℃生成的物质A,A是__________(化学式);A溶于水配成溶液,加入氨水,观察到的现象是_____________________________________________;最终得到溶液中的含铜元素的离子是_________________(化学式),该离子含有的化学键类型有___________________。
(3)将硫酸铜晶体加热到1000℃以上生成的物质C,在C中的铜的离子的基态电子排布式是____________;
(4)如图是硫酸铜晶体分解得到一定温度的产物的晶胞(白球和黑球代表不同的原子)。
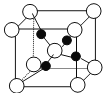
①该温度是_______________。
②铜原子的配位数是_______________。
③已知该晶体的密度为dg·cm-3,则晶胞参数是_________________pm。
【答案】
(1)X-射线衍射;sp3;V形
(2)CuSO4;首先形成蓝色沉淀,继续加入氨水,沉淀溶解,得到深蓝色溶液;[Cu(NH3)4]2+,配位键、极性键
(3)[Ar]3d10
(4)①1000℃以上②2③![]() ×1010
×1010
【解析】
试题分析:(1)测定蓝矾属于晶体的物理方法是X-射线衍射。其中SO42-中S原子价层电子对数=4+![]() (6+2-4×2)=4,采取sp3杂化;H2O中O原子价层电子对数=2+
(6+2-4×2)=4,采取sp3杂化;H2O中O原子价层电子对数=2+![]() (6-2×1)=4, 采取sp3杂化,空间构型为V形,故答案为:X-射线衍射;sp3;V形;
(6-2×1)=4, 采取sp3杂化,空间构型为V形,故答案为:X-射线衍射;sp3;V形;
(2)在5g胆矾中含有的结晶水的质量为5g×![]() =1.8g=5g-3.2g,A是硫酸铜;A溶于水配成溶液,加入氨水,首先形成蓝色沉淀,继续加入氨水,沉淀溶解,得到深蓝色溶液;最终得到溶液中形成铜氨络离子,该离子含有的化学键类型有配位键、极性共价键,故答案为:CuSO4;首先形成蓝色沉淀,继续加入氨水,沉淀溶解,得到深蓝色溶液;[Cu(NH3)4]2+,配位键、极性键;
=1.8g=5g-3.2g,A是硫酸铜;A溶于水配成溶液,加入氨水,首先形成蓝色沉淀,继续加入氨水,沉淀溶解,得到深蓝色溶液;最终得到溶液中形成铜氨络离子,该离子含有的化学键类型有配位键、极性共价键,故答案为:CuSO4;首先形成蓝色沉淀,继续加入氨水,沉淀溶解,得到深蓝色溶液;[Cu(NH3)4]2+,配位键、极性键;
(3) 5g胆矾中含有的铜元素的质量为5g×![]() =1.28g,将硫酸铜晶体加热到1000℃以上生成的物质C中含有氧元素的质量为1.44g-1.28g=0.16g,二者物质的量之比为0.02mol:0.01mol=2:1,为Cu2O,铜元素显+1价,+1价铜离子的基态电子排布式是[Ar]3d10,故答案为:[Ar]3d10;
=1.28g,将硫酸铜晶体加热到1000℃以上生成的物质C中含有氧元素的质量为1.44g-1.28g=0.16g,二者物质的量之比为0.02mol:0.01mol=2:1,为Cu2O,铜元素显+1价,+1价铜离子的基态电子排布式是[Ar]3d10,故答案为:[Ar]3d10;
(4)①白球的个数为8×![]() +1=2,黑球的个数为4,个数比为1:2,为Cu2O,该温度是1000℃以上,故答案为:1000℃以上;
+1=2,黑球的个数为4,个数比为1:2,为Cu2O,该温度是1000℃以上,故答案为:1000℃以上;
②黑球表示铜原子,白球表示O原子,氧原子的配位数是4,则铜原子的配位数是2,故答案为,2;
③设晶胞的边长为x,1mol晶胞的质量为288g,则x3×NA×dg·cm-3=288g,解得x=![]() cm=
cm=![]() ×1010 pm, 故答案为:
×1010 pm, 故答案为:![]() ×1010。
×1010。


科目:高中化学 来源: 题型:
【题目】新型储氢材料是开发利用氢能的重要研究方向。
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得。
①基态Cl原子中,电子占据的最高能层符号为______,该能层具有的原子轨道数为_______。
②LiBH4由Li+和BH4-构成,BH4-的立体结构是_________,B原子的杂化轨道类型是________。
Li、B、H元素的电负性由大到小排列顺序为________。
(2)金属氢化物是具有良好发展前景的储氢材料。
①LiH中,离子半径Li+_______H-(填“>”、“=”或“<”).
②某储氢材料是第三周期金属元素M的氢化物.M的部分电离能如表所示:

M是________ (填元素符号)。
(3)NaH具有NaCl型晶体结构,已知NaH晶体的晶胞参数a=488pm(棱长),Na+半径为102pm,H-的半径为________,NaH的理论密度是___________g·cm-3(只列算式,不必计算出数值,阿伏加德罗常数为NA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知乙烯能发生以下转化:

(1)乙烯的结构简式为: 。
(2)写出B、D化合物中官能团的名称:B ;D ;
(3)写出反应的化学方程式
①: 反应类型:
②: 反应类型:
③: 反应类型:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1molL-1HCl溶液滴定10.0mL浓度为0.1molL-1Na2CO3溶液,所得滴定曲线如图所示。下列微粒浓度大小关系正确的是

A.当V=0时:c(H+)+c(HCO3-)+2c(H2CO3)=c(OH-)
B.当V=5时:c(CO32-)+c(HCO3-)+c(H2CO3)=2c(Cl-)
C.当V=10时:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)
D.当V=a时:c(Na+)=c(Cl-)>c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数小于36的X、Y、Z、W四种元素,其中X是宇宙中含量最多的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的+1价阳离子的核外有3个电子层且各层均充满。
回答下列问题:
(1)W+的价电子排布式为 。
(2)Y2X2分子中Y原子轨道的杂化类型为 ,1mol Y2X2含有σ键的数目为 。
(3)化合物ZX3的沸点比化合物YX4的高,其主要原因是 。
(4)元素Y的一种氧化物与元素Z的一种氧化物互为等电子体,元素Z的这种氧化物的分子式是 。
(5)元素W的一种氯化物晶体的晶胞结构如图所示,该氯化物的化学式是 ,它可与浓盐酸发生非氧化还原反应,生成配合物H2WCl3,反应的化学方程式为 。在晶胞中最近的2个原子距离是apm,晶胞的密度是_____________g·cm-3(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)。
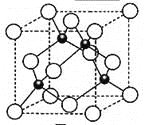
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇(CH3OH)是一种有毒物质,检测甲醇含量的测试仪工作原理示意图如下。下列说法正确的是( )
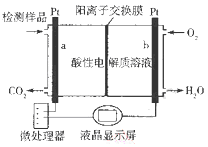
A. 该装置为电能转化为化学能的装置
B. a电极发生的电极反应为CH3OH + H2O - 6e-═ CO2↑ + 6H+
C. 当电路中有1 mol e-转移时,正极区n(H+)增加1 mol
D. 将酸性电解质溶液改为碱性电解质溶液该测试仪不可能产生电流
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有H+、Na+、NH4+、Fe3+、Al3+、SO![]() 、CO
、CO![]() 等离子。当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀物质的量随NaOH溶液体积变化的图像如图所示,下列说法正确的是( )
等离子。当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀物质的量随NaOH溶液体积变化的图像如图所示,下列说法正确的是( )
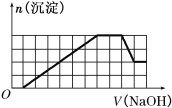
A.原溶液中含有的阳离子是H+、Fe3+、Al3+
B.原溶液中一定含有SO![]() 和Na+
和Na+
C.原溶液中含有的Fe3+和Al3+的物质的量之比为1∶1
D.反应最后形成的溶液中含有的溶质为Na2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅是太阳能电池的重要材料。工业冶炼纯硅的原理是:
粗硅冶炼:①SiO2 + 2C![]() Si + 2CO
Si + 2CO
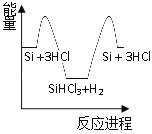
精炼硅:②Si + 3HCl![]() SiHCl3 + H2
SiHCl3 + H2
③SiHCl3 + H2![]() Si + 3HCl
Si + 3HCl
化学反应与能量变化如图所示,回答下列问题:
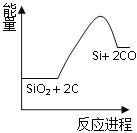
(1)反应①是_________反应(填“吸热”或“放热”),反应②是_________反应(填“吸热”或“放热”)。
(2)反应③破坏反应物中的化学键所吸收的能量_________形成生成物中化学键所放出的能量(填“大于”或“小于”)。
(3)研究物质变化时,人们可以从不同角度、不同层面来认识物质变化时所引起的化学键及能量变化。据此判断下列说法错误的是_________(双选)。
A.金属钠和氯气反应生成氯化钠后,其结构的稳定性增强,体系的能量降低
B.等量的硫蒸气和硫固体分别完全燃烧,前者放出的能量多
C.氮气分子内部存在着很强的共价键,故通常状况下氮气的化学性质很活泼
D.由石墨制取金刚石是吸热反应,可知金刚石比石墨稳定
E.由放热反应H2 + Cl2 ==== 2HCl来说,断裂1mol H—H键和1molCl—Cl键所吸收的能量小于形成2molH—Cl键所放出的能量
(4)在研究化学反应中的能量变化时,我们通常做下面的实验:
在一个小烧杯里,加入20g已经研磨成粉末的氢氧化钡晶体【Ba(OH)2.8H2O】,将小烧杯放在事先已滴有3—4滴水的玻璃片上,然后向烧杯中加入约10gNH4Cl晶体,并立即用玻璃棒迅速搅拌。写出实验过程中发生反应的化学方程式_________,该反应中反应物总能量_________生成物的总能量(填“大于”或“小于”),实验过程中立即用玻璃棒迅速搅拌的原因是_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com