
【题目】新型储氢材料是开发利用氢能的重要研究方向。
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得。
①基态Cl原子中,电子占据的最高能层符号为______,该能层具有的原子轨道数为_______。
②LiBH4由Li+和BH4-构成,BH4-的立体结构是_________,B原子的杂化轨道类型是________。
Li、B、H元素的电负性由大到小排列顺序为________。
(2)金属氢化物是具有良好发展前景的储氢材料。
①LiH中,离子半径Li+_______H-(填“>”、“=”或“<”).
②某储氢材料是第三周期金属元素M的氢化物.M的部分电离能如表所示:

M是________ (填元素符号)。
(3)NaH具有NaCl型晶体结构,已知NaH晶体的晶胞参数a=488pm(棱长),Na+半径为102pm,H-的半径为________,NaH的理论密度是___________g·cm-3(只列算式,不必计算出数值,阿伏加德罗常数为NA)
【答案】(1)①M;9;②正四面体;sp3;H>B>Li;
(2)①<;②Mg
(3)142pm![]()
【解析】
试题分析:(1)①基态Cl原子中电子占据的最高能层为第3能层,符号M,该能层有1个s轨道、3个p
轨道、5个d轨道,共有9 个原子轨道。
故答案为:M;9;
②BH4-中B原子价层电子数=4+![]() =4,B原子的杂化轨道类型是sp3杂化,且不含孤电子对,所以是正四面体构型,非金属的非金属性越强其电负性越大,非金属性最强的是H元素,其次是B元素,最小的是Li元素,所以Li、B、H元素的电负性由大到小排列顺序为H>B>Li。
=4,B原子的杂化轨道类型是sp3杂化,且不含孤电子对,所以是正四面体构型,非金属的非金属性越强其电负性越大,非金属性最强的是H元素,其次是B元素,最小的是Li元素,所以Li、B、H元素的电负性由大到小排列顺序为H>B>Li。
故答案为:正四面体;sp3;H>B>Li;
(2)①核外电子排布相同,核电荷数越大,离子半径越小,锂的质子数为3,氢的质子数为1,Li+、H-核外电子数都为2,所以半径Li+<H-。
故答案为:<;
②该元素的第III电离能剧增,则该元素属于第IIA族,为Mg元素。
故答案为:Mg;
(3)NaH具有NaCl型晶体结构,NaH晶体的晶胞参数a=488pm(棱长),Na+半径为102pm,H-的半径为![]() =142pm,该晶胞中钠离子个数=8×
=142pm,该晶胞中钠离子个数=8×![]() +6×
+6×![]() =4,氢离子个数=12×
=4,氢离子个数=12×![]() +1=4,NaH的理论密度是ρ=
+1=4,NaH的理论密度是ρ=![]() =
=![]() 。
。
故答案为:142pm;![]() 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】铜(Cu)是一种重要的常见金属,现代电子器件的电路离不开它,Cu的化合物在科学研究和工业生产中具有许多用途,如CuSO4溶液常用作电解液、电镀液等。请回答下列问题:
(1) 向CuSO4溶液里逐滴加入氨水,首先生成蓝色难溶物,然后得到深蓝色溶液。由蓝色难溶物得到深蓝色溶液的离子方程式为__________________ ;写出该深蓝色离子能反映出特殊共价键的结构简式________________;
(2) 元素金(Au)处于周期表中的第六周期,与Cu同族。一种铜金合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心、Au原子处于顶角位置,则该合金中Cu原子与Au原子数量之比为________;该晶体中,原子之间的作用力是________________________;
(3) 上述晶体具有储氢功能,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的最简化学式应为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】6种相邻周期主族元素的相对位置如下表,M元素原子核外电子数是Y元素原子核外电子数的2倍,W元素原子的次外层电子数是最外层电子数的2倍。用化学用语回答下列问题:

(1)Y在周期表中的位置是________。
(2)X、Y、Z三种元素的原子半径由大到小的顺序是________。
(3)W、M、Q三种元素最高价氧化物对应的水化物中,酸性由强到弱的顺序是________。
(4)W的最高价氧化物可以和Z的氢化物反应,利用该反应可刻蚀玻璃,反应的化学方程式是________。
(5)X的含10个电子 的气态氢化物甲是一种重要的化工原料。甲的电子式是 ,实验室制备甲的化学方程式是________, X的含18个电子的气态氢化物丙可与空气构成一种环保型碱性燃料电池,电池工作时丙发生的电极反应方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据表中短周期元素性质的数据判断,下列说法一定错误的是

A. ④是周期表中非金属性最强的元素
B. ①是周期表中原子半径最小的元素
C. ②④⑤在位于同一个周期
D. ①③两元素组成的化合物分子与③④两元素组成的化合物分子空间构型相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铅,又名石灰浆,可用于铅蓄电池、纤维增重剂、涂料分析试剂。工业上通常用自然界分布最广的方铅矿(主要成分为PbS)生产硫酸铅。工艺流程如下:

已知:①Ksp(PbSO4)=1.08×10-8,Ksp(PbCl2)=1.6×l0-5。
②PbCl2(s)+2C1-(aq)![]() PbCl42-(aq) △H>0
PbCl42-(aq) △H>0
③Fe3+、Pb2+以氢氧化物形式开始沉淀时的PH值分别为1.9和7。
(1)流程中加入盐酸可以控制溶液的pH<1.9,主要目的是__________________________。
反应过程中可观察到淡黄色沉淀,则①对应的离子方程式为_____________________。
(2)②所得的滤液A蒸发浓缩后再用冰水浴的目的是_____(请用平衡移动原理解释)
(3)④中对应反应的平衡常数表达式________。
(4)上述流程中可循环利用的物质有_________________。
(5)炼铅和用铅都会使水体因重金属铅的含量增大而造成严重污染。水溶液中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2、Pb(OH)3-、Pb(OH)42-。各形态的铅浓度分数x与溶液pH变化的关系如图所示:

①探究Pb2+的性质:向含Pb2+的溶液中逐滴滴加NaOH,溶液变浑浊,继续滴加NaOH溶液又变澄清;pH≥13时,溶液中发生的主要反应的离子方程式为_________________.。
②除去溶液中的Pb2+:科研小组用一种新型试剂可去除水中的痕量铅和其他杂质离子,
实验结果记录如下:

I.由表可知该试剂去除Pb2+的效果最好,请结合表中有关数据说明去除Pb2+比Fe3+效果好的理由是_____。
Ⅱ.若新型试剂(DH)在脱铅过程中主要发生的反应为:2DH(s)+Pb2+D2Pb(s)+2H+,则脱铅时最合适的pH约为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无色孔雀石绿(结构简式如图所示)曾被用作水产养殖业的杀虫剂(鱼药)。因为具有潜在致癌性,已被禁止用作鱼药。下列关于无色孔雀石绿的叙述中,正确的是
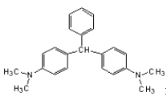
A. 分子中所有的碳原子可能在同一平面上
B. 无色孔雀石绿属于烃的衍生物
C. 无色孔雀石绿可与溴水中的溴发生加成反应
D. 在一定条件下,1mol无色孔雀石绿可以和9mol氢气发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)第二周期元素中,第一电离能介于B和O之间的元素有 。
(2)N、O可以组成微粒NO2+,它的电子式为 ,其等电子体有 (至少2种)。
(3)元素金(Au)处于周期表中的第六周期,与Cu同族,Au原子外围电子排布式为______;
(4)某有机物结构如下图所示,其分子中的原子除H外有 个以sp3杂化,2mol该分子含有π键的数目为

(5)已知Ti3+可形成配位数为6的配合物。现有含钛的两种颜色的晶体,一种为紫色,另一种为绿色,但相关实验证明,两种晶体的组成皆为TiCl3·6H2O。为测定这两种晶体的化学式,设计了如下实验:
a.分别取等质量的两种配合物晶体的样品配成待测溶液;
b.分别往待测溶液中滴入AgNO3溶液,均产生白色沉淀;
c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量,发现紫色晶体的水溶液与AgNO3溶液反应得到的白色沉淀质量为绿色晶体的水溶液反应得到沉淀质量的1.5倍。则绿色晶体配合物的化学式为 。(表示出内界和外界)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了预防碘缺乏症,国家规定每千克食盐中应含有40~50 mg碘酸钾。碘酸钾晶体具有较高的稳定性,但在酸性溶液中,碘酸钾是一种较强的氧化剂,能跟某些还原剂反应生成碘;在碱性溶液中,碘酸钾能被氯气、次氯酸等更强的氧化剂氧化为更高价的碘的含氧酸盐。工业生产碘酸钾的流程如图所示。
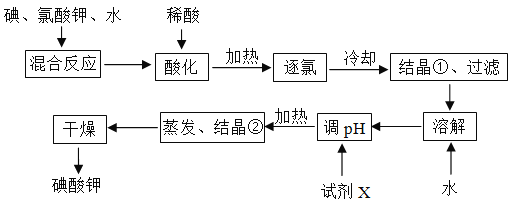
(1)碘在周期表中的位置为__________________;
(2)碘、氯酸钾、水混合反应时,若两种还原产物所得电子的数目相同,请配平该反应的化学方程式:____I2+____KClO3+____H2O=____KH(IO3)2+____KCl+____Cl2↑;
(3)混合反应后,用稀酸酸化的作用是___________________________,在稀盐酸和稀硝酸中不能选用的酸是_________,理由是__________________________________;
(4)试剂X的化学式为__________,写出用试剂X调pH的化学方程式__________________;
(5)如果省略“酸化”、“逐氯”、“结晶①、过滤”这三步操作,直接用试剂X调整反应混合物的pH,对生产碘酸钾有什么影响?________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铜晶体,俗称蓝矾、胆矾,具有催吐,祛腐,解毒。取5.0 g胆矾样品逐渐升高温度使其分解,分解过程的热重如下表。回答下列问题:
温度范围/℃ | 固体质量/g |
258~680 | 3.20 |
680~1000 | 1.60 |
1000以上 | 1.44 |
(1)测定蓝矾属于晶体的物理方法是____________。其中SO42-中S原子的轨道杂化形式是____________;H2O的空间构型是__________________。
(2)将硫酸铜晶体加热到258~680℃生成的物质A,A是__________(化学式);A溶于水配成溶液,加入氨水,观察到的现象是_____________________________________________;最终得到溶液中的含铜元素的离子是_________________(化学式),该离子含有的化学键类型有___________________。
(3)将硫酸铜晶体加热到1000℃以上生成的物质C,在C中的铜的离子的基态电子排布式是____________;
(4)如图是硫酸铜晶体分解得到一定温度的产物的晶胞(白球和黑球代表不同的原子)。
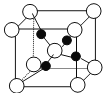
①该温度是_______________。
②铜原子的配位数是_______________。
③已知该晶体的密度为dg·cm-3,则晶胞参数是_________________pm。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com