
【题目】硫酸铅,又名石灰浆,可用于铅蓄电池、纤维增重剂、涂料分析试剂。工业上通常用自然界分布最广的方铅矿(主要成分为PbS)生产硫酸铅。工艺流程如下:

已知:①Ksp(PbSO4)=1.08×10-8,Ksp(PbCl2)=1.6×l0-5。
②PbCl2(s)+2C1-(aq)![]() PbCl42-(aq) △H>0
PbCl42-(aq) △H>0
③Fe3+、Pb2+以氢氧化物形式开始沉淀时的PH值分别为1.9和7。
(1)流程中加入盐酸可以控制溶液的pH<1.9,主要目的是__________________________。
反应过程中可观察到淡黄色沉淀,则①对应的离子方程式为_____________________。
(2)②所得的滤液A蒸发浓缩后再用冰水浴的目的是_____(请用平衡移动原理解释)
(3)④中对应反应的平衡常数表达式________。
(4)上述流程中可循环利用的物质有_________________。
(5)炼铅和用铅都会使水体因重金属铅的含量增大而造成严重污染。水溶液中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2、Pb(OH)3-、Pb(OH)42-。各形态的铅浓度分数x与溶液pH变化的关系如图所示:

①探究Pb2+的性质:向含Pb2+的溶液中逐滴滴加NaOH,溶液变浑浊,继续滴加NaOH溶液又变澄清;pH≥13时,溶液中发生的主要反应的离子方程式为_________________.。
②除去溶液中的Pb2+:科研小组用一种新型试剂可去除水中的痕量铅和其他杂质离子,
实验结果记录如下:

I.由表可知该试剂去除Pb2+的效果最好,请结合表中有关数据说明去除Pb2+比Fe3+效果好的理由是_____。
Ⅱ.若新型试剂(DH)在脱铅过程中主要发生的反应为:2DH(s)+Pb2+D2Pb(s)+2H+,则脱铅时最合适的pH约为________。
【答案】
(1)防止Fe3+的水解形成沉淀 ![]() ;
;
(2)用冰水浴的目的是用冰水浴使反应![]() 逆向移动,使PbCl4-不断转化为PbCl2晶体而析出。
逆向移动,使PbCl4-不断转化为PbCl2晶体而析出。
(3)![]() ;
;
(4)盐酸和氯化铁;
(5) ![]()
I.加入试剂Pb2+比Fe3+效果好的理由是加入试剂,二价铅离子浓度转化率为(0.1-0.004)/0.1*100%=96%,三价铁离子浓度转化率为(0.12-0.04)/0.12*100%=67%,所以去除二价铅离子比三价铁离子的效果好。
II.6。
【解析】
试题分析:(1)流程中加入盐酸可以控制溶液的pH<1.9,主要目的是防止Fe3+的水解形成沉淀。根据题中反应物为PbS、FeCl3,生成物中有S单质,结合题中所给的PbCl2难溶于水,可得方程式为:![]() ;(2)②所得的滤液A蒸发浓缩后再用冰水浴的目的是用冰水浴使反应
;(2)②所得的滤液A蒸发浓缩后再用冰水浴的目的是用冰水浴使反应![]() 逆向移动,使PbCl4-不断转化为Pb Cl2晶体而析出。(3)难溶物不要出现在表达式中,该对应的平衡常数表达式为:
逆向移动,使PbCl4-不断转化为Pb Cl2晶体而析出。(3)难溶物不要出现在表达式中,该对应的平衡常数表达式为:![]() ;(4)上述流程中可循环利用的物质有盐酸和氯化铁;(5) ①根据图可知该离子方程式为:
;(4)上述流程中可循环利用的物质有盐酸和氯化铁;(5) ①根据图可知该离子方程式为:![]() ,Pb2+比Fe3+效果好的理由是加入试剂,二价铅离子浓度转化率为(0.1-0.004)/0.1*100%=96%,三价铁离子浓度转化率为(0.12-0.04)/0.12*100%=67%,所以去除二价铅离子比三价铁离子的效果好。由图像可知要使铅以Pb2+存在,溶液的pH值在6左右。
,Pb2+比Fe3+效果好的理由是加入试剂,二价铅离子浓度转化率为(0.1-0.004)/0.1*100%=96%,三价铁离子浓度转化率为(0.12-0.04)/0.12*100%=67%,所以去除二价铅离子比三价铁离子的效果好。由图像可知要使铅以Pb2+存在,溶液的pH值在6左右。


 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源: 题型:
【题目】(实验)醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:
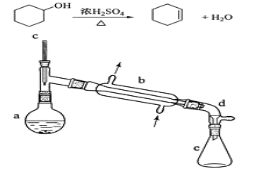
可能用到的有关数据如下:

合成反应:
在a中加入20 g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1 mL浓硫酸。b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃。
分离提纯:
反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙。最终通过蒸馏得到纯净环己烯10 g。
回答下列问题:
(1)装置a的名称是 。
(2)加入碎瓷片的作用是 ;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是 (填正确答案标号)。
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(3)分液漏斗在使用前须清洗干净并 ;在本实验分离过程中,产物应该从分液漏斗的 (填“上口倒出”或“下口放出”)。
(4)分离提纯过程中加入无水氯化钙的目的是 。
(5)在环己烯粗产物蒸馏过程中,可能用到的仪器有 (填正确答案标号)。
A圆底烧瓶 B温度计 C漏斗 D玻璃棒 E接收器
(6)本实验所得到的环己烯产率是 。(保留两位有效数字)
(注:产率=实际产量/理论产量×100%)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可由A和环己烯(![]() )为原料合成某重要的有机物X、Y,路线如下(部分反应条件略):
)为原料合成某重要的有机物X、Y,路线如下(部分反应条件略):

(1)B中含氧官能团的名称是___________。
(2)A的结构简式是______________。
(3)任选1种具有反式结构的C的同系物,用结构简式表示其反式结构_______。
(4)反应②、③、④、⑤中与反应①的类型相同的是_________。
(5)G→H的化学方程式是__________。
(6)E的结构简式是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 山梨酸是一种常用的食品防腐剂,以下是山梨酸(J)的一种工业合成途径:

已知:(1)A是衡量一个国家石油化工发展水平的重要标志。
(2)![]()
(3)![]()
(4)![]()
回答下列问题:
(1)E的结构简式为 ,含有官能团的名称为 。
(2)G和H在一定条件下合成I的化学方程式为 ,反应类型为 。
(3)写出满足下列条件的山梨酸的所有同分异构体 。①分子中有五元碳环;②核磁共振氢谱有四个峰;③分子中有—COO—结构
(4)下列说法正确的是 。
A.I可以发生加成、取代、氧化、消去反应
B.I可以和新制的氢氧化铜反应
C.1molI完全燃烧可以消耗7molO2
D.J和等物质的量的H2加成有两种产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“关爱生命,注意安全”。惨痛的天津爆炸触目惊心,火灾之后依然火势绵延不绝的原因之一是易燃物中含有电石。工业上常用电石(主要成分为CaC2,杂质为CaS等)与水反应生产乙炔气。
(1)工业上合成CaC2主要采用氧热法。
已知:CaO(s)+3C(s)=CaC2(s)+CO(g) △H=+464.1kJ·mol-1
C(s)+l/2O2(g)=CO(g) △H=-110.5kJ.mol-1
若不考虑热量耗散,物料转化率均为100%,最终炉中出来的气体只有CO,为维持热平衡,每生产l molCaC2,转移电子的物质的量为_______。
(2)已知2000℃时,合成碳化钙的过程中还可能涉及到如下反应
CaO(s)+C(s) ![]() Ca(g)+CO(g) K1 △H1=a KJ·mol-1
Ca(g)+CO(g) K1 △H1=a KJ·mol-1
Ca(g)+2C(s) ![]() CaC2(s) K2 △H2=b KJ·mol-1
CaC2(s) K2 △H2=b KJ·mol-1
2CaO(s)+CaC2(s) ![]() 3Ca(g)+2CO(g) K3 △H3=c KJ·mol-1
3Ca(g)+2CO(g) K3 △H3=c KJ·mol-1
则K1=_______ (用含K2、K3的代数式表示);c=_____(用含a、b的代数式表示)。
(3)利用电石产生乙炔气的过程中产生的H2S气体制取H2,既廉价又环保。

①利用硫化氢的热不稳定性制取氢气。在体积为2L的恒容密闭容器中,H2S起始物质的量为2mol,达到平衡后H2S的转化率![]() 随温度和压强变化如图l所示。据图计算T1℃时压强P1时,硫为气态,则平衡体系中H2的体积分数_____。由图知压强P1__P2(填“大于”“小于”或“等于”),理由是______。
随温度和压强变化如图l所示。据图计算T1℃时压强P1时,硫为气态,则平衡体系中H2的体积分数_____。由图知压强P1__P2(填“大于”“小于”或“等于”),理由是______。
②电化学法制取氢气的原理如图2,请写出反应池中发生反应的离子方程式_____,惰性电极a上发生的电极反应式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型储氢材料是开发利用氢能的重要研究方向。
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得。
①基态Cl原子中,电子占据的最高能层符号为______,该能层具有的原子轨道数为_______。
②LiBH4由Li+和BH4-构成,BH4-的立体结构是_________,B原子的杂化轨道类型是________。
Li、B、H元素的电负性由大到小排列顺序为________。
(2)金属氢化物是具有良好发展前景的储氢材料。
①LiH中,离子半径Li+_______H-(填“>”、“=”或“<”).
②某储氢材料是第三周期金属元素M的氢化物.M的部分电离能如表所示:

M是________ (填元素符号)。
(3)NaH具有NaCl型晶体结构,已知NaH晶体的晶胞参数a=488pm(棱长),Na+半径为102pm,H-的半径为________,NaH的理论密度是___________g·cm-3(只列算式,不必计算出数值,阿伏加德罗常数为NA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4既是一种重要的能源,也是一种重要的化工原料。
(1)已知E(N-N)=a kJ/mol,E(N≡N)=b kJ/mol,E(N-H)=c kJ/mol,E(H-O)=d kJ/mol,E(O=O)=e kJ/mol,则:
N2H4(g)+O2(g)=N2(g)+2H2O(l) △H=____________________kJ·mol-1
(2)以CH4为燃料可设计成结构简单、能量转化率高、对环境无污染的燃料电池,其工作原理如图1所示,则通入a气体的电极名称为 ,通入b气体的电极反应式为 。(质子交换膜只允许H+通过)

(3)在一定温度和催化剂作用下,CH4和CO2可直接生成乙酸,这是实现“减排”的一种研究方向。
①在不同温度下,催化剂的催化效率与乙酸的生成速率如图2所示,则该反应的最佳温度控制在 左右。
②该反应催化剂的有效成分为偏铝酸亚铜(CuAlO2,难容物),将CuAlO2溶解在稀硝酸中生成两种盐并放出NO气体,其离子方程式为 。
(4)CH4还原法是处理NOX气体的一种方法。已知一定条件下CH4与NOX反应转化为N2和CO2,若标准状况下8.96L CH4可处理22.4L NOX,则X值为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水合肼 (N2H4·H2O) 常用作还原剂和抗氧剂,其熔点为 -40℃,沸点 118.5℃,极毒。实验室用如下装置制取水合肼(N2H4·H2O)涉及下列反应:

CO(NH2)2+ 2NaOH +NaClO = Na2CO3 + N2H4·H2O + NaCl
N2H4·H2O + 2NaClO = N2↑ + 3H2O + 2NaCl]
请回答下列问题:
(1)配制30%NaOH溶液时,所需玻璃仪器除量筒外,还有 (填标号)。
A.容量瓶 B.烧杯 C.烧瓶 D.玻璃棒
(2)将Cl2通入30%NaOH溶液制备NaClO的化学方程式 。
(3)实验时,如果将 NaOH 和NaClO的混合溶液一次性加入三颈烧瓶,可能会造成的结果是__________。
(4)实验时可根据_________判断N2H4·H2O开始蒸出。
(5)已知:N2H4·H2O + 2I2= N2↑+ 4HI + H2O。测定水合肼的质量分数可采用下列步骤:
①取1.250g试样,经溶解、转移、定容等步骤,配制250mL溶液。
②移取10.00mL溶液于锥形瓶中,滴入几滴淀粉溶液,加20mL水,摇匀。
③将0.1000mol·L-1碘的标准溶液盛放在__________滴定管中(填“酸式”或“碱式”),当_____________停止滴定,消耗碘的标准溶液为18.00mL,则产品中N2H4·H2O的质量分数为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1molL-1HCl溶液滴定10.0mL浓度为0.1molL-1Na2CO3溶液,所得滴定曲线如图所示。下列微粒浓度大小关系正确的是

A.当V=0时:c(H+)+c(HCO3-)+2c(H2CO3)=c(OH-)
B.当V=5时:c(CO32-)+c(HCO3-)+c(H2CO3)=2c(Cl-)
C.当V=10时:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)
D.当V=a时:c(Na+)=c(Cl-)>c(H+)=c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com