
【题目】 常温下,醋酸和氨水的电离平衡常数均为1.8×10-5。向10mL浓度为0.1molL-1的NH3H2O溶液中滴加相同浓度的CH3COOH(温度变化忽略不计),在滴加过程中( )
A.c(NH4+)与c(NH3H2O)之和始终保持不变
B.水的电离程度始终增大
C.![]() 始终减小
始终减小
D.当加入CH3COOH的体积为10mL时,溶液pH>7
 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:
【题目】 山梨酸是一种常用的食品防腐剂,以下是山梨酸(J)的一种工业合成途径:

已知:(1)A是衡量一个国家石油化工发展水平的重要标志。
(2)![]()
(3)![]()
(4)![]()
回答下列问题:
(1)E的结构简式为 ,含有官能团的名称为 。
(2)G和H在一定条件下合成I的化学方程式为 ,反应类型为 。
(3)写出满足下列条件的山梨酸的所有同分异构体 。①分子中有五元碳环;②核磁共振氢谱有四个峰;③分子中有—COO—结构
(4)下列说法正确的是 。
A.I可以发生加成、取代、氧化、消去反应
B.I可以和新制的氢氧化铜反应
C.1molI完全燃烧可以消耗7molO2
D.J和等物质的量的H2加成有两种产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水合肼 (N2H4·H2O) 常用作还原剂和抗氧剂,其熔点为 -40℃,沸点 118.5℃,极毒。实验室用如下装置制取水合肼(N2H4·H2O)涉及下列反应:

CO(NH2)2+ 2NaOH +NaClO = Na2CO3 + N2H4·H2O + NaCl
N2H4·H2O + 2NaClO = N2↑ + 3H2O + 2NaCl]
请回答下列问题:
(1)配制30%NaOH溶液时,所需玻璃仪器除量筒外,还有 (填标号)。
A.容量瓶 B.烧杯 C.烧瓶 D.玻璃棒
(2)将Cl2通入30%NaOH溶液制备NaClO的化学方程式 。
(3)实验时,如果将 NaOH 和NaClO的混合溶液一次性加入三颈烧瓶,可能会造成的结果是__________。
(4)实验时可根据_________判断N2H4·H2O开始蒸出。
(5)已知:N2H4·H2O + 2I2= N2↑+ 4HI + H2O。测定水合肼的质量分数可采用下列步骤:
①取1.250g试样,经溶解、转移、定容等步骤,配制250mL溶液。
②移取10.00mL溶液于锥形瓶中,滴入几滴淀粉溶液,加20mL水,摇匀。
③将0.1000mol·L-1碘的标准溶液盛放在__________滴定管中(填“酸式”或“碱式”),当_____________停止滴定,消耗碘的标准溶液为18.00mL,则产品中N2H4·H2O的质量分数为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知乙烯能发生以下转化:

(1)乙烯的结构简式为: 。
(2)写出B、D化合物中官能团的名称:B ;D ;
(3)写出反应的化学方程式
①: 反应类型:
②: 反应类型:
③: 反应类型:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼及其化合物在工业上有许多用途.工业上以铁硼矿为原料制备硼酸,铁硼矿含有Mg、Fe、Ca、Al、B、O等多种元素,它的主要成分为Mg2B2O5H2O和Fe3O4.
(1)基态铁原子的外围电子层排布为______________,该元素位于元素周期表中的第______________族,在水溶液中常以Fe2+、Fe3+的形式存在,其中______________更稳定.
(2)以硼酸为原料可制得NaBH4,B原子的杂化方式为______________。
(3) 第ⅤA族元素的原子R与A原子结合形成RA3气态分子,其立体结构呈三角锥形.RCl5在气态和液态时,分子结构如图所示,下列关于RCl5分子的说法中不正确的是( )

A.分子中5个R-Cl键键能不都相同
B.键角(Cl-R-Cl)有90°、120、180°几种
C.RCl5受热后会分解生成分子立体结构呈三角锥形的RCl3
D.每个原子都达到8电子稳定结构
(4)因为氯化铝易升华,其双聚物Al2Cl6结构如图1所示.1mol该分子中含______________个配位键,该分子______________(填“是”或“否”)平面型分子.
(5)纯叠氮酸(HN3)在常温下是一种液体,沸点较高,为308. 8 K,主要原因是______________。
(6)二硫化碳属于_____________ (填“极性”或“非极性”)分子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1molL-1HCl溶液滴定10.0mL浓度为0.1molL-1Na2CO3溶液,所得滴定曲线如图所示。下列微粒浓度大小关系正确的是

A.当V=0时:c(H+)+c(HCO3-)+2c(H2CO3)=c(OH-)
B.当V=5时:c(CO32-)+c(HCO3-)+c(H2CO3)=2c(Cl-)
C.当V=10时:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)
D.当V=a时:c(Na+)=c(Cl-)>c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇(CH3OH)是一种有毒物质,检测甲醇含量的测试仪工作原理示意图如下。下列说法正确的是( )
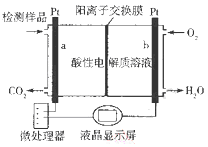
A. 该装置为电能转化为化学能的装置
B. a电极发生的电极反应为CH3OH + H2O - 6e-═ CO2↑ + 6H+
C. 当电路中有1 mol e-转移时,正极区n(H+)增加1 mol
D. 将酸性电解质溶液改为碱性电解质溶液该测试仪不可能产生电流
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理研究碳、氮等单质和化合物的反应有重要意义。
(1)有科学家提出可利用FeO吸收和利用CO2,相关热化学方程式如下:
6 FeO(s)+CO2(g)=2Fe3O4(s)+C(s) △H= -76.0 kJ·mol一1
①上述反应中每生成1 mol Fe3O4,转移电子的物质的量为_______mol。
②已知:C(s)+2H2O(g)=CO2 (g)+2H2(g) △H=+113.4 kJ·mol一1,则反应:
3 FeO(s)+ H2O (g)= Fe3O4 (s)+ H2 (g)的△H=__________。
(2)工业生产可以用NH3(g)与CO2(g)经两步反应生成尿素〔CO(NH2)2〕,两步反应的能量变化示意图如下:
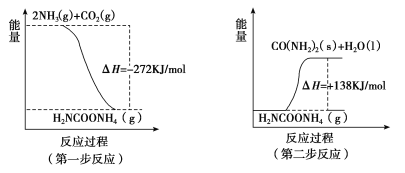
则NH3(g)与CO2(g)反应生成尿素的热化学方程式为____________________。
(3)氨气在纯氧中燃烧,生成一种单质和水,科学家利用此原理,设计成氨气一氧气燃料电池,则通入氨气的电极是 (填“正极”或“负极”);碱性条件下,该电极发生反应的电极反应式为 。
(4)华盛顿大学的研究人员研究出一种方法,可实现水泥生产时CO2零排放,其基本原理如图所示:
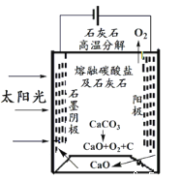
①上述生产过程的能量转化方式是_____________。
a、电能转化为化学能
b、太阳能转化为电能
c、太阳能转化为化学能
d、化学能转化为电能
②上述电解反应在温度小于 900℃时进行,碳酸钙先分解为CaO和CO2,电解质为熔融碳酸钠,阴极反应式为3CO2+4e-=C+2CO32-,则阳极的电极反应式为_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com