
【题目】现有金属单质A、B、C和气体甲、乙、丙以及物质D、E、F、G、H,它们之间的相互转化关系如下图所示(图中有些反应的生成物和反应的条件没有标出)。
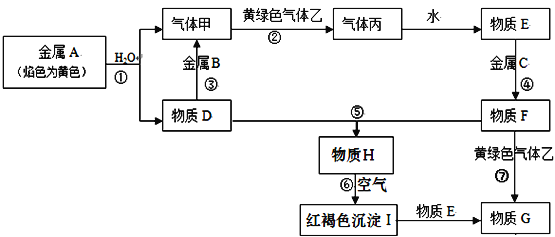
请回答下列问题:
(1)写出下列物质的化学式:B_________,乙_________
(2)根据要求回答:
1)D溶液和F溶液在空气中混合的现象:_______________________;
2)反应③离子方程式___________________________________________________;
3)反应⑦离子方程式___________________________________________________;
4)反应⑥化学方程式___________________________________________________。
【答案】 Al Cl2 产生白色沉淀迅速变成灰绿色,最后变为红褐色 2Al+2OH-+2H2O =2AlO2-+3H2↑ 2Fe2++2Cl2=2Cl-+2Fe3+ 4Fe(OH)2+ O2+2H2O=4Fe(OH)3
【解析】考查无机推断,金属A的焰色为黄色,说明金属A为Na,金属钠与H2O反应:2Na+2H2O=2NaOH+H2↑,气体甲为H2,物质D为NaOH,金属B能与NaOH反应生成氢气,则金属B为Al,乙为黄绿色气体,则乙为Cl2,气体丙为HCl,HCl溶于水形成盐酸,即物质E为盐酸,红褐色沉淀I为Fe(OH)3,物质G为FeCl3,根据元素守恒,推出物质F为FeCl2,即金属C为Fe,物质H为Fe(OH)2,(1)根据上述分析,B为Al,乙为Cl2;(2)1)NaOH和FeCl2反应的方程式为FeCl2+2NaOH=Fe(OH)2↓+2NaCl,Fe(OH)2容易被氧气氧化,发生4Fe(OH)2+O2+2H2O=4Fe(OH)3,现象是产生白色絮状沉淀,迅速变为灰绿色,最后变为红褐色;2)反应③的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑;3)反应⑦离子方程式为2Fe2++Cl2=2Fe3++2Cl-;4)反应⑥的化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3。


科目:高中化学 来源: 题型:
【题目】向容积为2 L的密闭容器中充人2 mol A气体和1 mol B气体,在一定条件下发生如下反应:2A(g)+B(g) ![]() 3C(g);经2 s后达到平衡,测得C气体的浓度为0.6 mol·L-1。下列说法中正确的是
3C(g);经2 s后达到平衡,测得C气体的浓度为0.6 mol·L-1。下列说法中正确的是
①用物质A表示该反应的平均反应速率为0.2 mol·L-1·s-1
②用物质B表示该反应的平均反应速率为0.2 mol·L-1·s-1
③平衡时物质A与B的转化率相等
④平衡时物质B的浓度为0.2 mol·L-1
A. ①②③ B. ①③ C. ②④ D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】青蒿素是一种高效、速效抗疟药,是中医药献给世界的一份礼物.屠呦呦因在发现、研究青蒿素方面做出的杰出贡献而获得2015年诺贝尔医学奖.青蒿素分子结构如图,下列说法中正确的是( ) 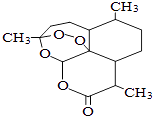
A.青蒿素能与热的NaOH溶液反应
B.青蒿素的分子式为C15H21O5
C.青蒿素分子结构中只含有极性键
D.青蒿素能使酸性KMnO4溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:在酸性条件下发生的反应为AsO43﹣+2I﹣+2H+═AsO33﹣+I2+H2O,在碱性条件下发 生的反应为AsO33﹣+I2+2OH﹣═AsO43﹣+H2O+2I﹣ . 设计如图装置(C1、C2均为石墨电极),分别进行下述操作: Ⅰ.向B烧杯中逐滴加入浓盐酸,发现电流表指针发生偏转
Ⅱ.若改向B烧杯中逐滴加入40% NaOH溶液 发现电流表指针偏转方向与Ⅰ相反. 试回答下列问题:
(1)两次操作过程中指针偏转方向为什么相反?试用化学平衡移动原理解释 .
(2)操作Ⅰ过程中C1棒为极,发生的电极反应为 .
(3)操作Ⅱ过程中C2棒为极,发生的电极反应为 . 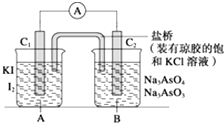
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质,按混合物、化合物、单质顺序排列的是( )
A. 碘酒、烧碱、液态氧B. 熟石灰、生石灰、白磷
C. 氯化氢、干冰、铁D. 胆矾、酒精、氮气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质,可用一种试剂加以区别的是( )
①四种无机溶液:NaAlO2、AlCl3、K2CO3、Na2SiO3
②四种白色粉末:(NH4)2SO4、NH4Cl、Na2SO4、NaCl
③四种有机溶液:乙醛、乙酸、甲酸、乙醇
④四种有机物:苯、四氯化碳、己烯、无水醋酸
A.只有①②
B.只有③④
C.只有①②④
D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“自元时始创其法,用浓酒和糟入甑,蒸令气上…其清如水,味极浓烈,盖酒露也。”文中所用之“法”是指( )
A. 萃取B. 渗析C. 蒸馏D. 过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】非金属虽然种类虽然不多,但是与人类的关系密切,回忆几种常见非金属一硅、氯、硫、氮及其化合物的重要性质,回答下列问题:
(1)在无机非金属材料中,硅一直扮演着主要的角色,有下列物品或设备:①陶瓷餐具②砖瓦③水泥路桥④门窗玻璃⑤水晶镜片⑥人工制造的分子筛⑦玛瑙手镯⑧硅太阳能电池⑨石英光导纤维⑩计算机芯片。所用材料为SiO2或要用到SiO2的是_______。
A.④⑤⑦⑧⑨ B.④⑤⑦⑨ C.④⑤⑦⑨ D.①④⑤⑦⑨⑩
(2)1774年,瑞典化学家舍勒在研究软锰矿的过程中发现了氯气。现为了进行有关氯气的性质实验,需要4瓶容积为50mL的氯气(室温下,氯气的密度约为2.9g/L),则用舍勒的方法制取3瓶氯气理论上需要MnO2固体的质量是_____g(保留到小数点后一位,浓盐酸过量,可以补充);实际称量的MnO2固体的质量必须多于理论量,其原因是_____,由于氯气有毒,拆除装置时需要对反应装置内氯气进行处理,以下最理想的吸收剂是_____
A.NaOH溶液 B.浓氨水 C.澄清石灰水 D.水
(3)硫酸和硝酸都是重要的化工原料,在工业上可以用于制化肥、农药、炸药、盐类等。
①现以洗净的废铜屑和浓硝酸为原料,制取硝酸铜,请设计一个既能节约原料又能防止污染环境的方法(用化学方程式表示)____________。
②下列现象中硫酸所表现出的性质中含有强氧化性的是________。
A.把锌粒放入稀硫酸中时,有气体放出
B.盛有浓硫酸的烧杯敞口放置一段时间后,质量增加
C.把浓硫酸倒入润湿的蔗糖中,蔗糖变黑,且有刺激性气味气体生成
D.把木炭放入热的浓硫酸中时,有气体放出
E.在常温下可以用铁、铝制容器盛装冷的浓硫酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com